Открытие
Ацетилен был открыт в 1836 году Эдмундом Дэви , который определил его как «новый карбюратор водорода». Это было случайное открытие при попытке выделить металлический калий . Нагревая карбонат калия с углеродом при очень высоких температурах, он получил остаток того, что сейчас известно как карбид калия (K 2 C 2 ), который вступил в реакцию с водой с выделением нового газа. Он был повторно открыт в 1860 году французским химиком Марселеном Бертло , который придумал название ацетилен . Эмпирическая формула Бертло для ацетилена (C 4 H 2 ), а также альтернативное название «quadricarbure d’hydrogène» ( квадрикарбид водорода ) были неправильными, потому что химики в то время использовали неправильную атомную массу для углерода (6 вместо 12). Бертло смог приготовить этот газ, пропуская пары органических соединений (метанол, этанол и т. Д.) Через красную трубу и собирая сточные воды . Он также обнаружил, что ацетилен образуется в результате искрения электричества через смесь газов цианогена и водорода . Позже Бертло получил ацетилен, пропуская водород между полюсами угольной дуги .
Горение ацетилена
Горение ацетилена происходит по реакции: С2Н2 + 2,5O2=2СO2 + Н2O + Q1
Для полного сгорания 1 м3 ацетилена по вышеуказанной реакции теоретически требуется 2,5 м3 кислорода или = 11,905 м3 воздуха. При этом выделяется тепло Q1 ? 312 ккал/моль. Высшая теплотворная способность 1 м3 С2Н2 при 0°C и 760 мм рт. ст., определенная в газовом калориметре, составляет QВ = 14000 ккал/м3 (58660 кДж/м3), что соответствует расчетной:
312?1,1709?1000/26,036 = 14000 ккал/м3
Низшая теплотворная способность при тех же условиях может быть принята QH = 13500 ккал/м3 (55890 кДж/м3).
Практически для горения в горелках при восстановительном пламени в горелку подается не 2,5 м3 кислорода на 1 м3 ацетилена, а всего лишь от 1 до 1,2 м3, что примерно соответствует неполному сгоранию по реакции:
С2H2 + О2 = 2СО + H2 + Q2
где Q2 ? 60 ккал/моль или 2300 ккал/кгС2H2. Остальные 1,5-1,3 м3 кислорода поступают в пламя из окружающего воздуха, в результате чего в наружной оболочке пламени протекает реакция:
2СО + H2 + 1,5О2 = 2СO2 + H2O + Q3
Реакция неполного горения ацетилена протекает на внешней оболочке светящегося внутреннего конуса пламени, причем под влиянием высокой температуры на внутренней поверхности конуса происходит распад С2Н2 на его составляющие по реакции:
С2H2 = 2С + H2 + Q4
где Q4?54 ккал/моль или 2070 ккал/кг С2H2.
Таким образом, общая полезная теплопроизводительность пламени применительно к сварочным процессам представляет собой сумму тепла, выделяемого при распаде С2Н2, и тепла, выделяемого при неполном сгорании, что составляет Q4 + Q2 = 2070 + 2300 = 4370 ккал/кг или 4370?1,1709 ? 5120 ккал/м3.
При содержании С2Н2 в смеси около 45% (т. е. при отношении кислорода к ацетилену, примерно равном 1,25) достигается максимальная температура горения ацетилена, которая составляет 3200°С.
При содержании 27% С2Н2 достигается максимальная скорость воспламенения ацетилено-кислородной смеси, которая равна 13,5 м/сек.
Данные зависимостей скорости воспламенения и температуры пламени и от содержания в ней ацетилена представлены ниже в таблице.
| Содержание С2Н2 в смеси в объемных процентах | 12 | 15 | 20 | 25 | 27 | 30 | 32 | 35 | 40 | 45 | 50 | 55 |
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Максимальная температура горения ацетилена, °С | — | 2920 | 2940 | 2960 | 2970 | 2990 | 3010 | 3060 | 3140 | 3200 | 3070 | 2840 |
| Скорость воспламенения смеси, м/сек | 8,0 | 10,0 | 11,8 | 13,3 | 13,5 | 13,1 | 12,5 | 11,3 | 9,3 | 7,8 | 6,7 | — |
Необходимо понимать, что полное сгорание ацетилено-воздушной смеси достигается при наличии в ней не более 1?100/(1+11,905)=7,75% ацетилена (так называемая стехиометрическая смесь). При этом продуктами реакции являются только (СО2) и вода (H2О). При содержании ацетилена более 17,37% в виде сажи выделяется свободный углерод.
С увеличение процентного содержание ацетила выделение сажи также возрастает (коптящее пламя), а при 81% С2Н2 — процесс горения прекращается или не возникает.
Технология и режимы сварки
Ацетилено — кислородные смеси применяют для соединения деталей из углеродистых и низколегированных сталей. Например, этот метод широко применяют для создания неразъемных соединений трубопроводов. Например, труб диаметром 159 мм с толщиной стенок не более 8 мм. Но существуют и некоторые ограничения, так соединение таким методом сталей марок 12×2M1, 12×2МФСР недопустимо.
 Сварка при помощи ацетилена
Сварка при помощи ацетилена
 Пламя при ацетиленовой сварке
Пламя при ацетиленовой сварке
Выбор параметров режима
Для приготовления смеси необходимой для соединения металлов используют формулу 1/1,2. При обработке заготовок из легированных сталей сварщик должен отслеживать состояние пламени. В частности, нельзя допускать переизбытка ацетилена.
Расход смеси с формулой кислород/ацетилен составляет 100-130 дм3/час на 1 мм толщины. Мощность пламени регулируют с помощью горелки, которые подбирают в зависимости от используемого материала, его характеристик, толщины и пр
Для выполнения сварки при помощи ацетилена применяют сварочную проволоку. Ее марка должна соответствовать марке сталей свариваемых деталей. Диаметр проволоки определяют в зависимости от толщины свариваемого металла.
Для удобства технологов и непосредственно сварщиков существует множество таблиц, на основании которых можно довольно легко выбрать сварочный режим. Для этого необходимо знать следующие параметры:
- толщину стенки свариваемых заготовок;
- вид сварки — левый, правый;
На основании этого можно определить диаметр присадочной проволоки и подобрать расход ацетилена. К примеру, толщина составляет 5-6 мм, для выполнения работ будет использован наконечник № 4. То есть на основании табличных данных диаметр проволоки будет составлять для левой сварки 3,5 мм, для правой 3. Расход ацетилена в таком случае будет составлять при левом способе 60 -780 дм3/час, при правом 650-750 дм3/час.
Сварку выполняют небольшими участками по 10-15 мм. Работа производится в следующей последовательности. На первом этапе выполняют оплавление кромок. После этого выполняют наложение корня шва. По окончании формирования корня, можно продолжать сварку далее. Если толщина заготовок составляет 4 мм то сварку допустимо выполнять в один слой. Если толщина превышает указанную, то необходимо наложить второй. Его укладывают только после того, как выполнен корень шва по всей заданной длине.
Для улучшения качества сварки допускается выполнение предварительного нагрева. То есть будущий сварной стык прогревают с помощью горелки. Если принят за основу такой способ, то прогрев надо выполнять после каждой остановки заново.
Выполнение швов газом может выполняться в любом пространственном положении. Например, при выполнении вертикального шва существуют свои особенности. Так, вертикальный шов должен исполняться снизу вверх.
При выполнении сварочных работ перерывы в работе недопустимы, по крайней мере до окончания всей разделки шва. При остановке в работе горелку необходимо отводить медленно, в противном случае, могут возникнуть дефекты шва — раковины и поры. Интересная особенность существует при сварке трубопроводов, в ней не допустим сквозняк и поэтому концы труб необходимо заглушать.
Реакции присоединения
Тройная связь состоит из σ-связи и двух π-связей. Сравним характеристики одинарной связи С–С, тройной связи С≡С и связи С–Н:
| Энергия связи, кДж/моль | Длина связи, нм | |
| С–С | 348 | 0,154 |
| С≡С | 814 | 0,120 |
| С–Н | 435 | 0,107 |
Таким образом, тройная связь С≡С короче, чем одинарная связь С–С, поэтому π-электроны тройной связи прочнее удерживаются ядрами атомов углерода и обладают меньшей поляризуемостью и подвижностью. Реакции присоединения по тройной связи к алкинам протекают сложнее, чем реакции присоединения по двойной связи к алкенам.
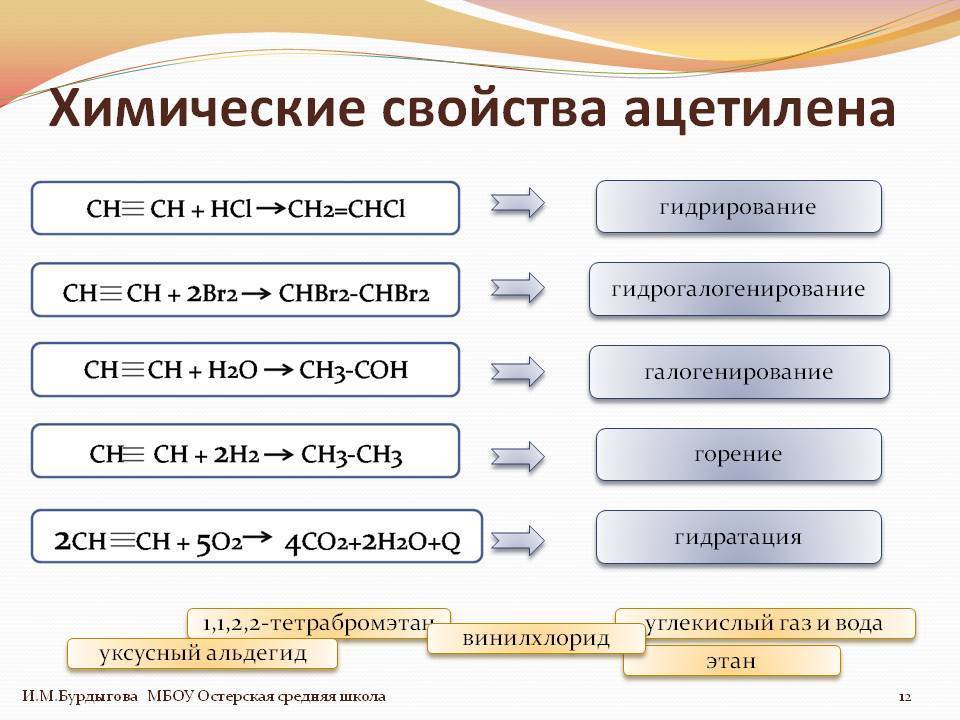
Для алкинов характерны реакции присоединения по тройной связи С≡С с разрывом π-связей.
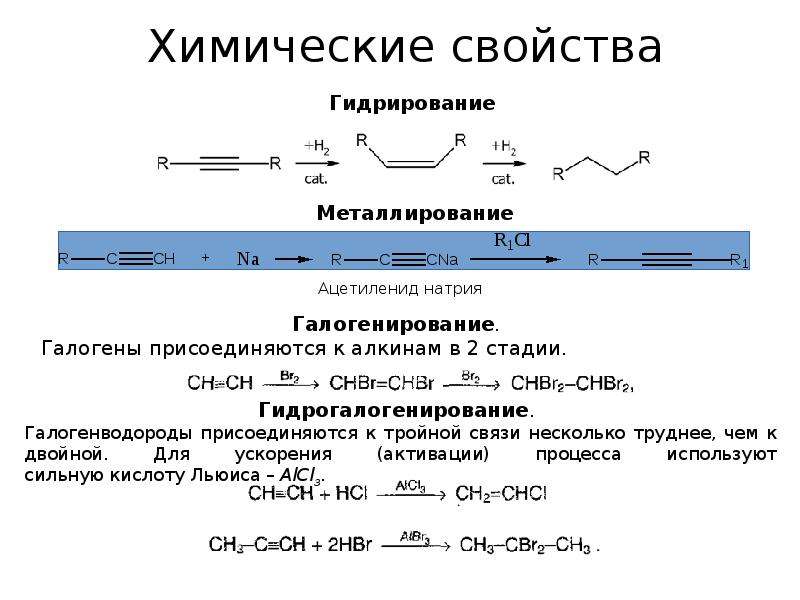
1.1. Гидрирование
Гидрирование алкинов протекает в присутствии катализаторов (Ni, Pt) с образованием алкенов, а затем сразу алканов.
| Например, при гидрировании бутина-2 в присутствии никеля образуется сначала бутен-2, а затем бутан. |
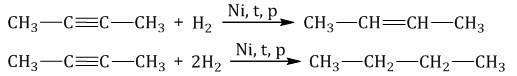
При использовании менее активного катализатора (Pd, СaCO3, Pb(CH3COO)2) гидрирование останавливается на этапе образования алкенов.
| Например, при гидрировании бутина-1 в присутствии палладия преимущественно образуется бутен-1. |
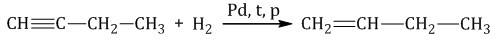
1.2. Галогенирование алкинов
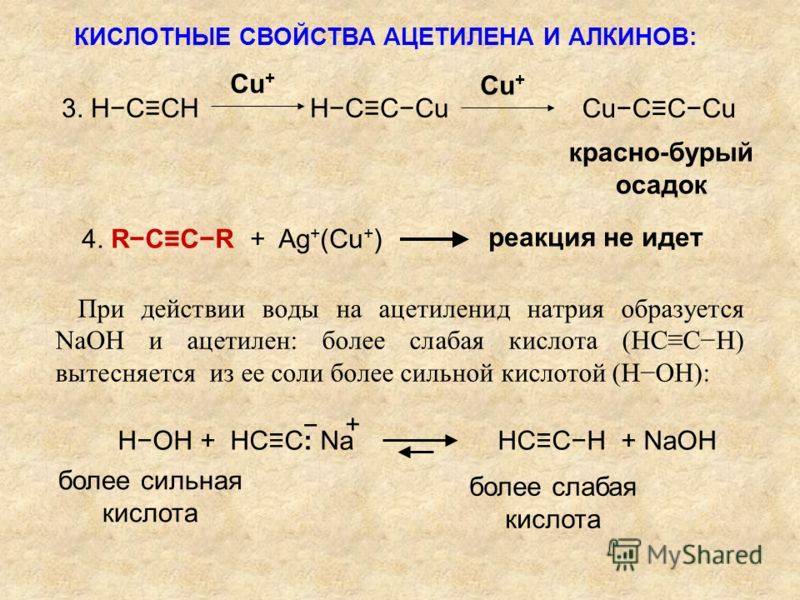
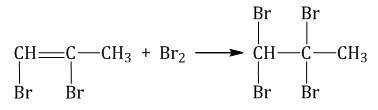
Присоединение галогенов к алкинам происходит даже при комнатной температуре в растворе (растворители — вода, CCl4).
| При взаимодействии с алкинами красно-бурый раствор брома в воде (бромная вода) обесцвечивается. Это качественная реакция на тройную связь. |
| Например, при бромировании пропина сначала образуется 1,2-дибромпропен, а затем — 1,1,2,2-тетрабромпропан. |
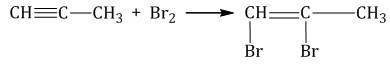
Аналогично алкины реагируют с хлором, но обесцвечивания хлорной воды при этом не происходит, потому что хлорная вода и так бесцветная)
Реакции протекают в присутствии полярных растворителей по ионному (электрофильному) механизму.
1.3. Гидрогалогенирование алкинов
Алкины присоединяют галогеноводороды. Реакция протекает по механизму электрофильного присоединения с образованием галогенопроизводного алкена или дигалогеналкана.
| Например, при взаимодействии ацетилена с хлороводородом образуется хлорэтен, а затем 1,1-дихлорэтан. |
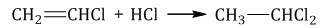
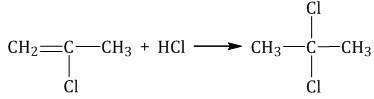
При присоединении галогеноводородов и других полярных молекул к симметричным алкинам образуется, как правило, один продукт реакции, где оба галогена находятся у одного атома С.
При присоединении полярных молекул к несимметричным алкинам образуется смесь изомеров. При этом выполняется правило Марковникова.
| Правило Марковникова: при присоединении полярных молекул типа НХ к несимметричным алкинам водород преимущественно присоединяется к наиболее гидрогенизированному атому углерода при двойной связи. |
| Например, при присоединении хлороводорода HCl к пропину преимущественно образуется 2-хлорпропен. |
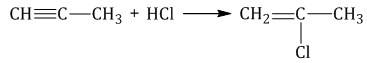
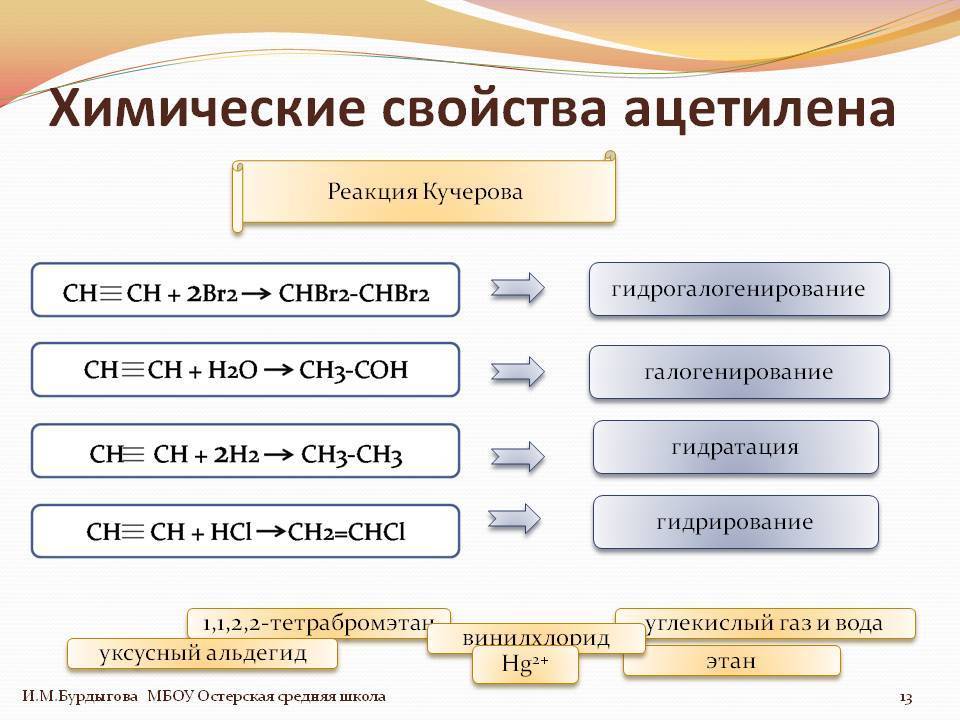
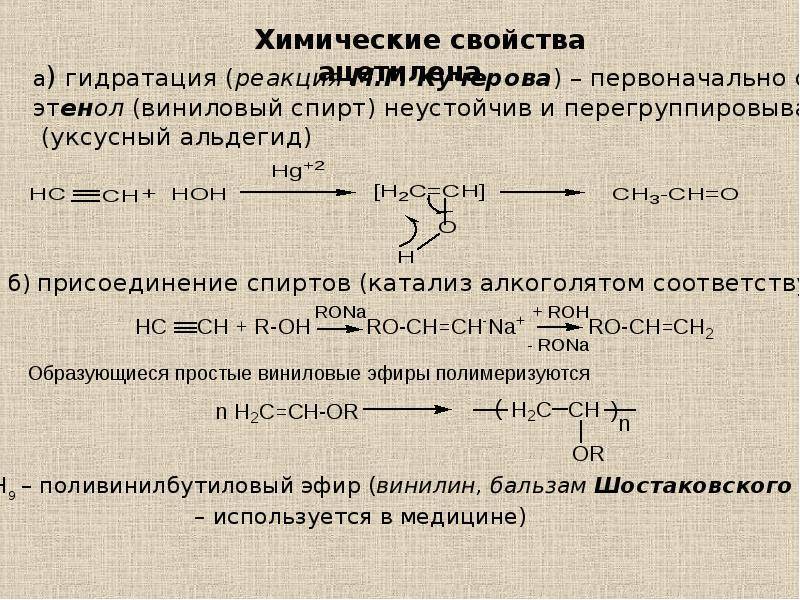
1.4. Гидратация алкинов
Гидратация (присоединение воды) алкинов протекает в присутствии кислоты и катализатора (соли ртути II).
Сначала образуется неустойчивый алкеновый спирт, который затем изомеризуется в альдегид или кетон.
| Например, при взаимодействии ацетилена с водой в присутствии сульфата ртути образуется уксусный альдегид. |
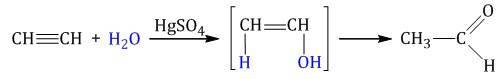
Гидратация алкинов протекает по ионному (электрофильному) механизму.
Для несимметричных алкенов присоединение воды преимущественно по правилу Марковникова.
| Например, при гидратации пропина образуется пропанон (ацентон). |
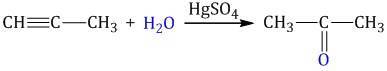
1.5. Димеризация, тримеризация и полимеризация
Присоединение одной молекулы ацетилена к другой (димеризация) протекает под действием аммиачного раствора хлорида меди (I). При этом образуется винилацетилен:
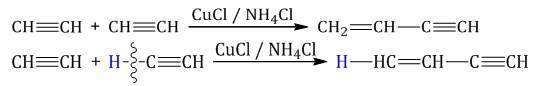
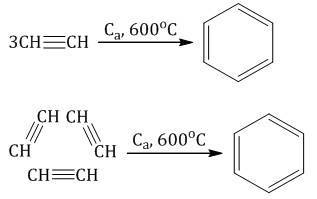
Тримеризация ацетилена (присоединение трех молекул друг к другу) протекает под действием температуры, давления и в присутствии активированного угля с образованием бензола (реакция Зелинского):
Алкины также вступают в реакции полимеризации — процесс многократного соединения молекул низкомолекулярного вещества (мономера) друг с другом с образованием высокомолекулярного вещества (полимера).
nM → Mn (M – это молекула мономера)
| Например, при полимеризации ацетилена образуется полимер линейного или циклического строения. |
… –CH=CH–CH=CH–CH=CH–…
Свойства ацетилена
В химически чистом виде ацетилен обладает слабым эфирным запахом. Технический ацетилен, благодаря наличию в нем примесей, в частности фосфористого водорода, имеет резкий специфический запах. Ацетилен легче воздуха. Газообразный ацетилен – бесцветный газ плотностью при 0 °С и 101,3 кПа (760 м рт. ст.) 1,173кг/м3. Молекулярная масса – 26,038.
Ацетилен способен растворяться во многих жидкостях. Его растворимость зависит от температуры: чем ниже температура жидкости, тем больше она способна «забрать» ацетилена. В практике производства растворенного ацетилена используют ацетон, который при температуре 15 °С растворяет до 23 объемов ацетилена.
Содержание фосфористого водорода в ацетилене должно быть строго ограничено, так как в момент образования ацетилена в присутствии воздуха при высокой температуре может произойти самовоспламенение.
Ацетилен — единственный широко используемый в промышленности газ, относящийся к числу немногих соединений, горение и взрыв которых возможны в отсутствии кислорода или других окислителей.
Еще в 1895 г. А.Л.Ле Шателье обнаружил, что ацетилен, сгорая в кислоте, дает очень горячее пламя (до 3150°С), поэтому его широко используют для сварки и резки тугоплавких металлов. Сегодня применение ацетилена для газопламенной обработки металлов испытывает сильную конкуренцию со стороны более доступных горючих газов (природный газ, пропан–бутан и т.д.). Однако преимущество ацетилена — в самой высокой температуре горения. В таком пламени очень быстро расплавляются даже толстые куски стали. Именно поэтому газопламенная обработка ответственных узлов машиностроительных конструкций производится только с помощью ацетилена, который обеспечивает наивысшую производительность и качество процесса сварки.
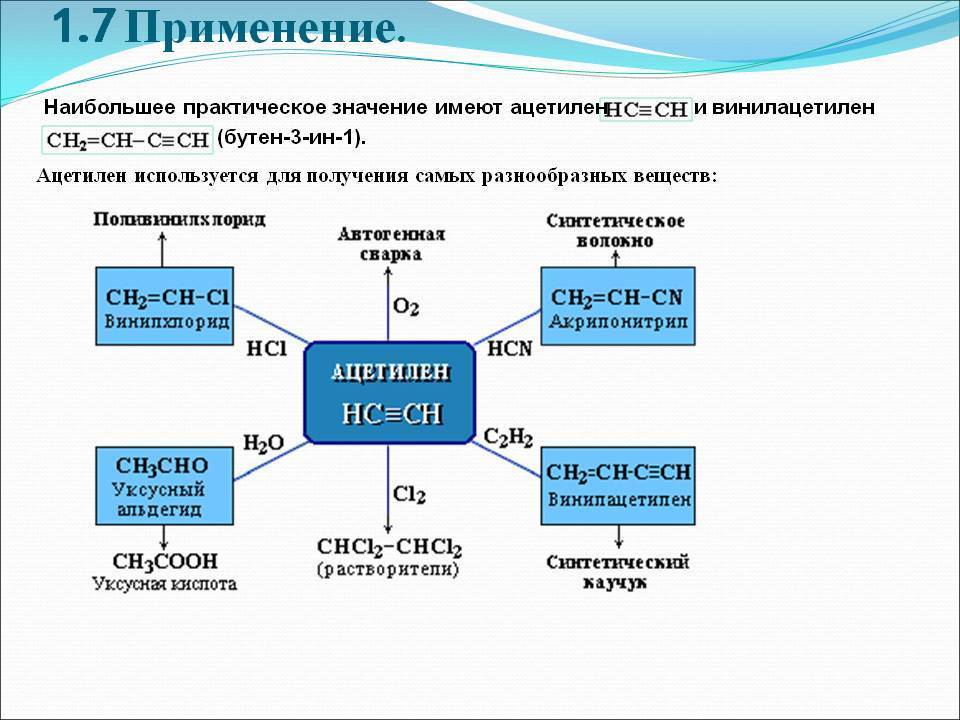
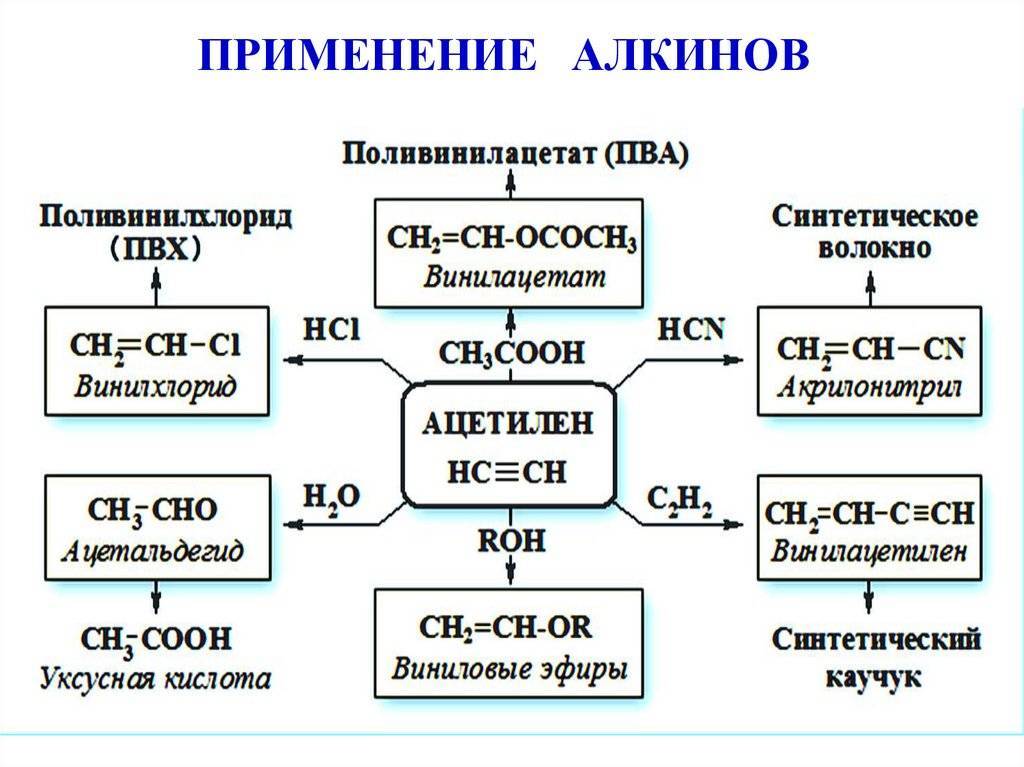
Кроме того, ацетилен широко используется в органическом синтезе разнообразных веществ — уксусного альдегида и уксусной кислоты, синтетических каучуков (изопренового и хлоропренового), поливинилхлорида и других полимеров.
Ссылки
| Углеводороды | |
| Алканы | Метан • Этан • Пропан • Бутан • Пентан • Гексан • Гептан • Октан • Нонан • Декан • Ундекан • Додекан • Тридекан • Тетрадекан • Гексадекан • Гептадекан • Октадекан • Нонадекан • Эйкозан • Докозан • Гектан |
| Алкены | Этилен • Пропен • Бутены • Пентены • Гексены • Гептены • Октен |
| Алкины | Ацетилен • Пропин • Бутин |
| Диены | Пропадиен • Бутадиен • Изопрен • Циклобутадиен |
| Другие ненасыщеные | Винилацетилен • Диацетилен • Каротин |
| Циклоалканы | Циклопропан • Циклобутан • Циклопентан • Циклогексан • Декалин • Индан • Инден |
| Ароматические | Бензол • Толуол • Диметилбензолы • Этилбензол • Пропилбензол • Кумол • Стирол • Фенилацетилен • Индан • Дифенил • Дифенилметан • Трифенилметан • Тетрафенилметан • Инден |
| Полициклические | Нафталин • Антрацен • Бензантрацен • Пентацен • Фенантрен • Пирен • Бензпирен • Азулен • Хризен |
ацетилен, ацетилен + вода, ацетилен википедия, ацетилен вікіпедія, ацетилен гарган авах, ацетилен донецк, ацетилен получение, ацетилен формула, ацетилен хлорирование, ацетиленовий генератор
Оборудование и материалы для ацетиленовой сварки
При газовой сварке в качестве горючего газа чаще всего применяется ацетилен, но из-за ряда причин его так же и заменяют другими газами. Кроме того ацетилен является не единственным газом и расходным материалом, который необходим для получения качественного соединения металлов.
Расходные материалы при газовой сварке
Ацетилен или заменяющий его газ
Он может быть в готовом виде (в баллоне), а так же в получаемом при разложении жидкости под действием электродугового разряда или при разложении карбида кальция водой. Остальные газы-заменители с низкой теплопроводностью применяются для отдельных металлов в качестве раскислителей. На их сгорание требуется разное количество кислорода, но они не являются экономичными.
Кислород
Для обеспечения достаточных температур и быстрого расплавления металлов пары горючих газов или сам газ сжигается с добавлением чистого кислорода. Для сварки используют технический кислород трех сортов, который оценивается по объему при атмосферном давлении:
- высший сорт — частота 99.5% + 0.5% азот;
- первый сорт — частота 99.2% + азот, аргон;
- второй сорт — частота 98.5% + азот и аргон.
Жидкий кислород при сварке не используется, но он более удобен и безопасен для транспортировки в теплоизолированных емкостях.
Присадочная проволока
Сварочная проволока используется в соответствии с химическим составом свариваемых металлов. Главным критерием ее подбора является температура плавления, которая должна быть чуть ниже температуры плавления металлов. В виде исключения для стали, меди, латуни и свинца проволока может быть заменена нарезанными тонкими полосками металла той же марки.
Флюсы
Сварочные пасты или порошки, называемые флюсами, применяются при сварке ацетиленом и его заменителями для защиты расплавленного металла от окисления и быстрого удаления уже образовавшихся пленок-окислов.
Проволока и края металлов обрабатываются флюсами, которые при нагреве образуют шлаки и всплывают на поверхность жидкого металла. Шлаковая пленка защищает сварочную ванну жидкого металла от окисления. выбор состава флюсов, как и присадочная проволока, зависит от вида свариваемых металлов.
Аппаратура для сварки
Применение газовой сварки требует одинакового набора аппаратуры вне зависимости от вида используемого горючего газа. Основным набором сварщика на сварочном посту является:
Водяной затвор. Он необходим для предотвращения воспламенения ацетилено-кислородной смеси в газовых каналах при так называемом обратном ударе. Защитный затвор всегда подсоединяется между горелкой или резаком и газопроводом к баллону или ацетиленовому генератору.
- Ацетиленовый генератор. Используется для получения ацетилена из карбида кальция путем добавления воды.
- Баллоны. Стальные бесшовные сосуды с запорным вентилем. Они необходимы для сжатого кислорода, а так же ацетилена, который находится под давлением и растворен в ацетоне. Все баллоны различаются по цветам.
- Вентили для баллонов. Используются только латунные для кислородных баллонов и только стальные для ацетиленовых. Запрещается использовать медь, так как ацетилен и медь образуют взрывчатое соединение.
- Редукторы. Используются для понижения давления отбираемого из баллона ацетилена и поддержания его на необходимом уровне. По конструкции они бывают однокамерные и двухкамерные.
- Рукава (шланги). Для подачи газа применяются шланги из вулканизированной резины и прокладками из ткани. Рукава для ацетилена и кислорода отличаются, но можно использовать и трубопровод с защитным клапаном.
- Газовые горелки. При ручной газовой сварки используются разнообразные горелки, которые необходимы для смешивания кислорода и ацетилена, то есть для регулировки мощности пламени.
Средства защиты сварщика и инструмент. Сварочная маска, очки, рукавицы, ключи баллонные, молоток и щетка по металлу для зачистки сварных швов.
Весь этот набор оборудования и расходных материалов является обязательным, но не минимальным. Для кислородной резки используют еще и горелку-резак. Из-за опасности проведения сварочных работ взрывоопасной смесью все оборудование должно проходить регулярные проверки и быть в полной исправности.
Гомологи ацетилена
Ацетилен — простейший представитель алкинов, в молекулах которых также присутствует тройная связь. Пропин СН3С≡СН — гомолог ацетилена. Формула третьего представителя алкинов — бутина-1 — СН3СН2С≡СН. Ацетилен — тривиальное название этина. Систематическая номенклатура алкинов подчиняется правилам ИЮПАК:
- в линейных молекулах указывается название основной цепи, возникшее от греческого числительного, к которому добавляется суффикс -ин и номер атома при тройной связи, например, этин, пропин, бутин-1;
- нумерацию главной цепочки атомов начинают с конца молекулы, ближайшего к тройной связи;
- для разветвленных углеводородов сначала идет наименование бокового ответвления, затем следует название главной цепочки атомов с суффиксом -ин.
- заключительная часть наименования — цифра, указывающая расположение в молекуле тройной связи, например, бутин-2.
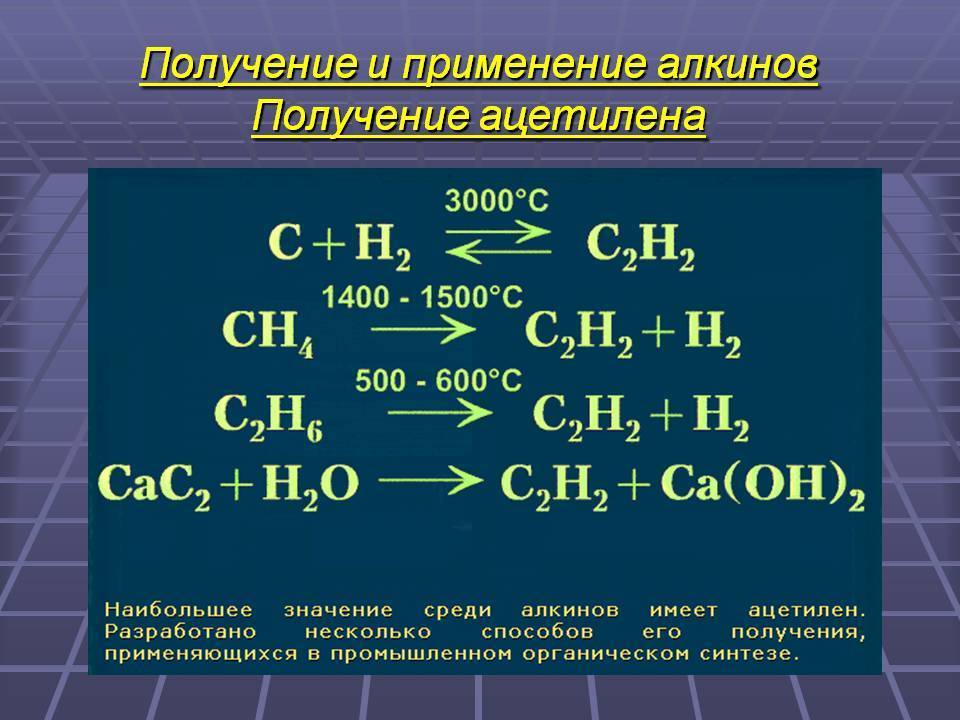
Получение
В лаборатории
В лаборатории, а также в газосварочном оборудовании, ацетилен получают действием воды на карбид кальция (Ф. Вёлер, 1862 год),
а также при дегидрировании двух молекул метана при температуре свыше 1400 °C:
2 C H 4 → C 2 H 2 + 3 H 2 {\displaystyle {\mathsf {2CH_{4}\rightarrow C_{2}H_{2}+3H_{2}}}}
В промышленности
В промышленности ацетилен получают гидролизом карбида кальция и пиролизом углеводородного сырья — метана или пропана с бутаном. В последнем случае ацетилен получают совместно с этиленом и примесями других углеводородов. Карбидный метод позволяет получать очень чистый ацетилен, но требует высокого расхода электроэнергии. Пиролиз существенно менее энергозатратен, т.к. для нагрева реактора используется сгорание того же рабочего газа во внешнем контуре, но в газовом потоке продуктов концентрация самого ацетилена низка. Выделение и концентрирование индивидуального ацетилена в таком случае представляет сложную задачу. Экономические оценки обоих методов многочисленны, но противоречивы.
Получение пиролизом
Электрокрекинг
Метан превращают в ацетилен и водород в электродуговых печах (температура 2000—3000 °С, напряжение между электродами 1000 В). Метан при этом разогревается до 1600 °С. Расход электроэнергии составляет около 13000 кВт•ч на 1 тонну ацетилена, что относительно много (примерно равно затрачиваемой энергии по карбидному методу) и потому является недостатком процесса. Выход ацетилена составляет 50 %.
Регенеративный пиролиз
Иное название — Вульф-процесс. Сначала разогревают насадку печи путём сжигания метана при 1350—1400 °С. Далее через разогретую насадку пропускают метан. Время пребывания метана в зоне реакции очень мало и составляет доли секунды. Процесс реализован в промышленности, но экономически оказался не таким перспективным, как считалось на стадии проектирования.
Окислительный пиролиз
Метан смешивают с кислородом. Часть сырья сжигают, а образующееся тепло расходуют на нагрев остатка сырья до 1600 °С. Выход ацетилена составляет 30—32 %. Метод имеет преимущества — непрерывный характер процесса и низкие энергозатраты. Кроме того, с ацетиленом образуется еще и синтез-газ. Этот процесс (Заксе-процесс или BASF-процесс) получил наиболее широкое внедрение.
Гомогенный пиролиз
Является разновидностью окислительного пиролиза. Часть сырья сжигают с кислородом в топке печи, газ нагревается до 2000 °С. Затем в среднюю часть печи вводят остаток сырья, предварительно нагретый до 600 °С. Образуется ацетилен. Метод характеризуется большей безопасностью и надёжностью работы печи.
Пиролиз в струе низкотемпературной плазмы
Процесс разрабатывается с 1970-х годов, но, несмотря на перспективность, пока не внедрён в промышленности. Сущность процесса состоит в нагреве метана ионизированным газом. Преимущество метода заключается в относительно низких энергозатратах (5000—7000 кВт•ч) и высоких выходах ацетилена (87 % в аргоновой плазме и 73 % в водородной).
Карбидный метод
Этот способ известен с XIX века, но не потерял своего значения до настоящего времени. Сначала получают карбид кальция, сплавляя оксид кальция и кокс в электропечах при 2500—3000 °С:
C a O + 3 C → C a C 2 + C O {\displaystyle {\mathsf {CaO+3C\rightarrow CaC_{2}+CO}}}
Известь получают из карбоната кальция:
C a C O 3 → C a O + C O 2 {\displaystyle {\mathsf {CaCO_{3}\rightarrow CaO+CO_{2}}}}
Далее карбид кальция обрабатывают водой:
C a C 2 + 2 H 2 O → C 2 H 2 + C a ( O H ) 2 {\displaystyle {\mathsf {CaC_{2}+2H_{2}O\rightarrow C_{2}H_{2}+Ca(OH)_{2}}}}
Получаемый ацетилен имеет высокую степень чистоты 99,9 %. Основным недостатком процесса является высокий расход электроэнергии: 10000—11000 кВт•ч на 1 тонну ацетилена.
Молекулярная формула ацетилена
Этин — простейший член своего гомологического ряда, его состав и строение отражают формулы:
- С2Н2 — молекулярная запись состава этина, которая дает представление о том, что вещество образовано двумя углеродными атомами и таким же числом атомов водорода. По этой формуле можно рассчитать молекулярную и молярную массы соединения. Mr (С2Н2) = 26 а. е. м., М (С2Н2) = 26,04 г/моль.
- Н:С:::С:Н — электронно-точечная формула ацетилена. Подобные изображения, получившие название «структуры Льюиса», отражают электронное строение молекулы. При написании необходимо соблюдать правила: атом водорода стремится при образовании химической связи обладать конфигурацией валентной оболочки гелия, другие элементы — октетом внешних электронов. Каждое двоеточие означает общую для двух атомов или неподеленную пару электронов внешнего энергетического уровня.
- H—C≡C—H — структурная формула ацетилена, отражающая порядок и кратность связей между атомами. Одна черточка заменяет собой одну пару электронов.
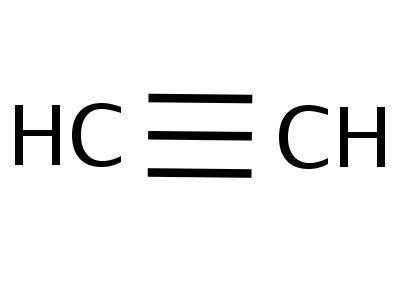
Ацетилен: применение в строительстве и промышленности
Автогенные и сварочные работы сопровождают практически все этапы строительства. Именно в этих видах работ применяется ацетилен. В специальном устройстве под названием горелка происходит смешивание газов и непосредственно сама реакция горения. Наивысшая температура данной реакции достигается при содержании ацетилена 45 % от всего объема баллона.

Баллоны с этим газом маркируют следующим образом: окрашивают в белый цвет и большими красными буквами наносят надпись: «Ацетилен»
Строительные работы проводятся в основном на открытом воздухе. Применение ацетилена и его гомологов в этих условиях не должно проходить под воздействием прямых солнечных лучей. Небольшие перерывы должны сопровождаться перекрыванием вентилей на горелке, а длительные – перекрыванием вентилей на самих баллонах.
Читать также: Захваты для металлических листов
В химической промышленности очень востребован ацетилен. Применение его заключается в использовании данного вещества в процессе получения продуктов органического синтеза. Это синтетический каучук, пластмассы, растворители, уксусная кислота и т.д.
Ацетилен, являясь универсальным горючим, часто используется в процессах, сопровождающихся газопламенной обработкой
Важно, что применение ацетилена в промышленности возможно только при соблюдении мер безопасности, так как он является взрывоопасным газом

Преимущества растворенного ацетилена
Основное преимущество растворенного ацетилена перед тем, который получают с использованием переносных генераторов из карбида кальция, состоит в том, что при применении баллонов происходит повышение труда сварщика примерно на 20 %, а потери ацетилена при этом снижаются на 25 %. Также следует отметить повышение оперативности и маневренности сварочного поста, безопасность. В отличие от газа, полученного из карбида кальция, растворенный ацетилен содержит значительно меньше посторонних веществ, то есть примесей, что позволяет использовать его в особо ответственных сварочных работах.
Виды ацетилена
Промышленность выпускает два вида ацетилена — твердый и в виде газа.
Газообразный
Ацетилен обладает резким запахом и это дает определённые преимущества при его утечке. По своей массе он близок к атмосферному воздуху.
Жидкий
Жидкий ацетилен не обладает ни каким цветом. У него есть одна особенность он преломляет цвет. Ацетилен и жидкий, и газообразный, представляет собой опасное вещество. То есть при нарушении правил обращения с ним взрыв может произойти в любую секунду, даже при комнатной температуре. Для повышения безопасности при обращении с ним, применяют так называемую флегматизацией. То есть в ёмкости, предназначенной для хранения ацетилена размещают пористое вещество. Которое снижает его опасность
Применение и получение ацетилена.
Ацетилен – это один из наиболее значимых углеводородов с тройной связью. Он является первым представителем ряда ацетилена, а также бесцветным газом, который практически не растворим в воде. Молекула ацетилена имеет на два атома водорода меньше, чем в молекуле этилена, и при этом характерно образование третьей связи между атомами углерода.
Применение ацетилена:
1) может применяться в качестве горючего при газовой сварке и резке металлов;
2) используется также для синтеза различных органических соединений;
3) в результате присоединения хлора к ацетилену получают растворитель – 1,1,2,2-тетрахлорэтан. Путем дальнейшей переработки тетрахлорэтана получаются другие хлорпроизводные;
4) при отщеплении хлороводорода от 1,1,2,2-тетрахлорэтана образуется трихлорэтен – растворитель высокого качества, который широко применяется при чистке одежды: СНСI = ССI2;
5) в больших количествах ацетилен идет на производство хлорэтена, или винилхлорида, с помощью полимеризации которого получается поливинилхлорид (используется для изоляции проводов, изготовления плащей, искусственной кожи, труб и других продуктов);
6) из ацетилена получаются и другие полимеры, которые необходимы в производстве пластмасс, каучуков и синтетических волокон.
Получение ацетилена:
1) в лабораториях и промышленности ацетилен чаще всего получается карбидным способом. Если кусочки карбида кальция поместить в сосуд с водой или если воду добавлять к карбиду кальция, начинается сильное выделение ацетилена: СаС2 + 2НОН → С2Н2 + Са(ОН)2. Со стороны промышленности полимерных материалов карбидный способ является малоэффективным. Он связан с большими затратами электроэнергии на получение карбида кальция.
Особенности карбида кальция:
А) карбид кальция получают в электропечах;
Б) получается при взаимодействии извести с углеродом (коксом, антрацитом);
В) получается при температуре 2000 °С: СаО + 3С → СаС2 + СО;
2) применяется способ получения ацетилена из более доступного химического сырья – природного газа (метана).
Особенности получения ацетилена из метана: а) если метан нагревать до высокой температуры, то он разлагается на углерод и водород; б) одним из промежуточных продуктов этой реакции становится ацетилен: 2СН4 → 2С + 4Н2;
В) одной из характерных черт получения ацетилена из метана являются две идеи:
– выделить его на промежуточной стадии;
– не дать ацетилену возможности разложиться на углерод и водород.
Для этого образующийся ацетилен необходимо быстро удалить из зоны высокой температуры и охладить.
Преимущества
Упоминание о газовой сварке моментально наводит на мысли об ацетилене. Действительно для этого процесса чаще всего применяют этот газ. Он в сочетании с кислородом обеспечивает самую высокую температуру горения пламени. Но в последние годы из-за развития различных видов сварки использование этого вида соединения металлов несколько снизилось. Более того, в некоторых отраслях произошел полный отказ от применения этих технологий. Но для выполнения определенного вида ремонтных работ она до сих пор остается незаменима.
Применение ацетилена позволяет получить следующие преимущества:
- максимальная температура пламени;
- существует возможность генерации ацетилена непосредственно на рабочем месте или приобретения его в специальных емкостях;
- довольно низкая стоимость, в сравнении с другими горючими газами.
Вместе с тем, у ацетилена есть и определенные недостатки, которые ограничивают его использование. Самый главный — это взрывоопасность. При работе с этим газом необходимо строго соблюдать меры безопасности. В частности, работы должны выполняться в хорошо проветриваемом помещении. При нарушении режимов работы возможно появление некоторых дефектов, например, пережогов.
Горение ацетилена
Горение ацетилена происходит по реакции: С2Н2 + 2,5O2=2СO2 + Н2O + Q1
Для полного сгорания 1 м3 ацетилена по вышеуказанной реакции теоретически требуется 2,5 м3 кислорода или = 11,905 м3 воздуха. При этом выделяется тепло Q1 ? 312 ккал/моль. Высшая теплотворная способность 1 м3 С2Н2 при 0°C и 760 мм рт. ст., определенная в газовом калориметре, составляет QВ = 14000 ккал/м3 (58660 кДж/м3), что соответствует расчетной:
312?1,1709?1000/26,036 = 14000 ккал/м3
Низшая теплотворная способность при тех же условиях может быть принята QH = 13500 ккал/м3 (55890 кДж/м3).
Практически для горения в горелках при восстановительном пламени в горелку подается не 2,5 м3 кислорода на 1 м3 ацетилена, а всего лишь от 1 до 1,2 м3, что примерно соответствует неполному сгоранию по реакции:
С2H2 + О2 = 2СО + H2 + Q2
где Q2 ? 60 ккал/моль или 2300 ккал/кгС2H2. Остальные 1,5-1,3 м3 кислорода поступают в пламя из окружающего воздуха, в результате чего в наружной оболочке пламени протекает реакция:
2СО + H2 + 1,5О2 = 2СO2 + H2O + Q3
Реакция неполного горения ацетилена протекает на внешней оболочке светящегося внутреннего конуса пламени, причем под влиянием высокой температуры на внутренней поверхности конуса происходит распад С2Н2 на его составляющие по реакции:
С2H2 = 2С + H2 + Q4
где Q4?54 ккал/моль или 2070 ккал/кг С2H2.
Таким образом, общая полезная теплопроизводительность пламени применительно к сварочным процессам представляет собой сумму тепла, выделяемого при распаде С2Н2, и тепла, выделяемого при неполном сгорании, что составляет Q4 + Q2 = 2070 + 2300 = 4370 ккал/кг или 4370?1,1709 ? 5120 ккал/м3.
При содержании С2Н2 в смеси около 45% (т. е. при отношении кислорода к ацетилену, примерно равном 1,25) достигается максимальная температура горения ацетилена, которая составляет 3200°С.
При содержании 27% С2Н2 достигается максимальная скорость воспламенения ацетилено-кислородной смеси, которая равна 13,5 м/сек.
Данные зависимостей скорости воспламенения и температуры пламени и от содержания в ней ацетилена представлены ниже в таблице.
| Содержание С2Н2 в смеси в объемных процентах | 12 | 15 | 20 | 25 | 27 | 30 | 32 | 35 | 40 | 45 | 50 | 55 |
| Максимальная температура горения ацетилена, °С | — | 2920 | 2940 | 2960 | 2970 | 2990 | 3010 | 3060 | 3140 | 3200 | 3070 | 2840 |
| Скорость воспламенения смеси, м/сек | 8,0 | 10,0 | 11,8 | 13,3 | 13,5 | 13,1 | 12,5 | 11,3 | 9,3 | 7,8 | 6,7 | — |
Необходимо понимать, что полное сгорание ацетилено-воздушной смеси достигается при наличии в ней не более 1?100/(1+11,905)=7,75% ацетилена (так называемая стехиометрическая смесь). При этом продуктами реакции являются только углекислый газ (СО2) и вода (H2О). При содержании ацетилена более 17,37% в виде сажи выделяется свободный углерод.
С увеличение процентного содержание ацетила выделение сажи также возрастает (коптящее пламя), а при 81% С2Н2 — процесс горения прекращается или не возникает.