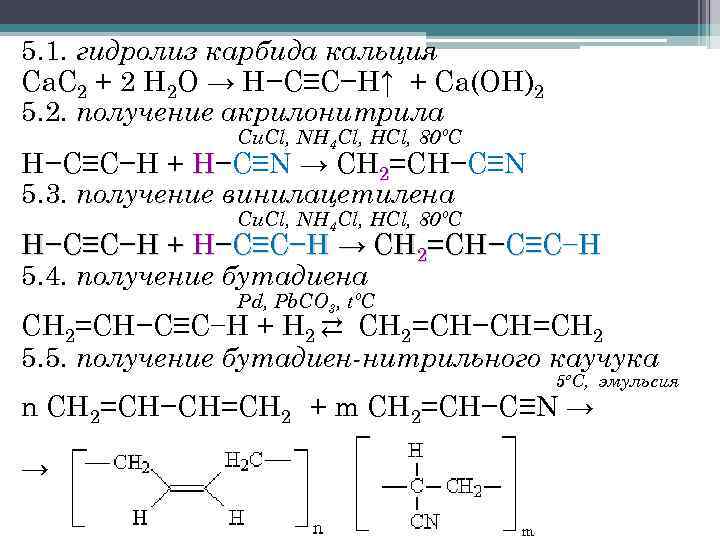
Применение
Как уже упоминалось, чаще всего это вещество можно встретить на стройке. И там ему находят десятки способов применения. В шлифовке без этого материала трудно обойтись, из него производят спец. диски. Но хорош он не только в качестве абразива, но и в виде острых режущих кругов, ножей и тому подобного.
Машиностроение – еще одна возможность использовать это соединение. Из карбида получаются не только различные детали автомобилей, но и зап. части для радио приборов. А благодаря своей теплопроводности он отлично справится и с задачей нагревательного типа. Даже в ядерной промышленности без такого составляющего никак. Все это требует особой прочности, поэтому здесь речь чаще всего о ковалентных видах.
Те составы, что содержат карбид железа, позволяют получить сталь, и всем известный чугун. Кремниевые соединения так же ценят ювелиры и производители осветительных элементов. Искусственный каучук и смолы, и даже уксусная кислота – настолько широк круг применения карбидов.
Но этим дело не ограничивается. Этот искусственный минерал еще и для огородников важен. Ведь с его помощью получают особый вид удобрений. Они способны регулировать скорость роста различных культур.
Но, пожалуй, самый популярный из всех – карбид кальция. Ведь именно его в своей работе активно используют сварщики. Казалось бы, как этот темный камушек с чесночным ароматом может быть задействован в таком процессе?
Очень просто, ведь для газовой сварки, что логично, нужен горючий газ. В нашем случае дает карбид ацетилен. Как только он «встречается» с кислородом, мы получаем весьма интенсивное пламя, его температурные показатели переступают отметку в три тысячи градусов.
Читать также: Диски для продольного пиления древесины для циркулярки
Если брать уже готовый летучий газ, то упаковкой ему служат спец. емкости, в них вещество доставляют к месту действия. Никакой тряски, или ударов во время такой поездки быть не должно – смертельно опасно.
Это сырье может вспыхнуть, даже без лишней «помощи», потому внимание всегда должно быть на пределе. Если же пожара избежать не удалось, никакой влаги при тушении
В ход должны идти только порошковые способы тушения.

Есть второй путь – произвести это «топливо» прямо на месте работ. Для этого нужно знать, что такое гидролиз карбидов. Говоря проще, это реакция соединения на контакт с водой. Причем, этот самую реакцию может вызвать даже одна капля.
Потому, если собрались осуществить сварочные работы, предельно аккуратно вскрываем герметичную тару с карбидом
Особо важно, чтобы никаких признаков огня по соседству, иначе ЧП гарантированно. О сигаретах и вовсе стоит забыть
Еще следите за тем, чтобы даже самые мелкие крошки не оказались на Вашей коже, тем более на слизистых, иначе, в лучшем случае – раздражение, с худшем- ожоги и распухшие части тела. Так что вооружайтесь спец. обмундирование: защитить нужно все, с ног до головы, в том числе и дыхательные пути. Первая помощь, если контакта избежать не удалось: обильно поливаем водой пораженный участок, покрываем его плотным кремом. При необходимости вызвать врача.
Если говорить о расходе, если масса карбида один килограмм, то это дает возможность выработать до трехсот кубических дециметров газа. Это достаточно хорошие показатели. Так же на такое количество сырья потребуется примерно литров 20 воды, хотя производители и заявляют, что достаточно будет полулитра. То, сколько времени все это займет, зависит от величины фракций соединения, и их чистоты.
После того, как с работой закончили, оставшиеся отходы, а это шлак из извести, не оставляем где попало, а утилизируем. Для таких работ потребуется спец. генератор. Бывают они внушительных размеров, их устанавливают на одном месте, к примеру, когда планируются масштабные работы. Но существует и мини-версия, переносная.
Сначала отсек, в котором и должен образоваться газ, заливаем водой, потом уже добавляем туда карбид. Идет реакция, появившийся в результате ацетилен по мягкой трубке поступает непосредственно к газовой горелке. Этот путь должен быть достаточно длинным, шланг обязательно нужно выбрать не короче десяти метров.
Идет в дело и карбид бора. Предметы на его основе дают надежную защиту от огня. И не только от огня, кстати, ведь такой товар активно используют изготовители бронежилетов. Во-первых, он «ловит» пули, а во-вторых, не даст прохода и радиации. Что касается такого союза, как карбид алюминия, то сверкающие искры во время фейерверков – его заслуга. А ведь на вид это ничем не примечательный желтый порошок.
Как применять карбид против кротов
Карбид кальция в упаковке
Имеется несколько способов, как использовать карбид:
- Просто заложить несколько кусков карбида в кротовую нору и оставить до начала реакции;
- В пластиковые бутылки поместить комковой карбид и налить воды. Закопать эти емкости в норки. Выделившийся ацетилен прогонит кротов раз и навсегда;
- Некоторые садоводы-любители прибегают к более жестким мерам. После выделения газа в норах, его поджигают, обезжизнивая животных.
Но эти меры не всегда помогают избавиться от навязчивых зверьков-вредителей.
Возможно Вам будет интересно — Инструкция по применению гипохлорита кальция для дезинфекции
Преимущества и недостатки метода
Карбид является отличным стимулятором роста некоторых растений. Это, пожалуй, единственное преимущество данного вещества. В основном от него одни недостатки:
- Популяция кротов гибнет, причем особи страдают мучительной смертью.
- Повышается уровень щелочи в почве.
- Уничтожаются живые организмы, обитающие в земле (черви, жуки).
- Высокая опасность возникновения пожара.
Поэтому прежде чем выбрать данный способ борьбы с животными, нужно ознакомиться с имеющимися альтернативными путями. Их очень много: ветряки, консервные банки, отпугиватели из полторашек.
Еще стоит отметить, что крота легко прогнать с огорода, если он непосредственно окажется рядом с карбидом, иначе это пустая трата времени и сил.
Меры безопасности и хранение
Calcium carbide относится к 1 классу опасности по степени воздействия на организм. Его пыль раздражающе действует на кожные покровы, слизистые оболочки и дыхательные пути. Реагент очень опасен при вдыхании (симптомы: прерывистое дыхание, кашель, насморк, чувство удушья, отек легких), попадании на кожные покровы (получение ожогов, язв) и в глаза (резь, слезотечение, отек век).
При применении материала необходимо использовать специальную защитную одежду, противогаз, перчатки и специальную обувь. Работать только в хорошо проветриваемых помещениях. В случае попадания на кожу промыть пораженное место большим количеством воды, смазать жирным кремом и вызвать врача.
Хранить в герметичных тарах в вертикальном положении (не более, чем в 3 ряда) в несгораемых, хорошо вентилируемых складах или на открытых площадках под навесом, защищающих от воздействия влаги. Не допускается совместное хранение с другими веществами. Срок годности – 6 месяцев с даты производства.
Применение материалов
Карбиды металлов применяются производстве (в основном — в тяжелом). Перечислим основные варианты применения:
Простые карбидные соединения на основе железа могут добавлять в металлический сплав (чугун, сталь, чистое железо), чтобы улучшить его физико-химические свойства. Дополнительные компоненты улучшают прочность, повышают химическую инертность, минимизируют риск коррозии под действием воды или атмосферного воздуха. Еще одно полезное свойство — увеличение температуры плавления, что удобно в случае изготовления тугоплавких запчастей или деталей.
Карбиды на основе титана или вольфрама отличаются сверхвысокой прочностью, а плавятся они при сверхвысоких температурах. Поэтому из них делают режущие и абразивные инструменты, которые отличаются высоким сроком годности. Подобные соединения можно использовать в качестве огнеупорных материалов (скажем, при производстве печей), для изготовления сварочных стержней.
Карбид кальция обладает необычным свойством — при контакте с водой происходит ряд химических реакций, что в конечном счете приводит к образованию ацетилена. Это вещество широко применяется для кислородной сварки, резки или напайки. Поэтому такое карбидное соединение может использоваться для изготовления соответствующих деталей (электроды для сварочных инструментов, напайка и другие)
Ацетилен при горении выделяет большое количество тепла, поэтому к работам нужно подойти осторожно.
Упаковка карбида кальция
При упаковке карбида кальция во влажной атмосфере в результате реакции с водой, содержащейся в воздухе, в барабане образуется некоторое количества ацетилена, поэтому открытие барабана следует производить медленно во избежание выброса карбидной пыли.
Например, барабан, в котором хранится 100 кг карбида кальция, имеет емкость около 80 л. Объем кусков карбида равен примерно 42 л. Следовательно, между кусками карбида кальция остается свободное пространство в 38 л, занятое газом. Если бы барабаны были совершенно герметичны и наполнялись в сухой атмосфере, то все свободное пространство было бы занято только воздухом, однако практически эти условия невыполнимы, и благодаря взаимодействию с влагой, содержащейся в воздухе, небольшое количество ацетилена всегда будет образовываться в барабане. Достаточно примерно 1 л ацетилена в воздухе, заполняющем свободное пространство барабана, чтобы ацетилено-воздушная смесь могла вспыхнуть от искры.
Во время наполнения барабана в сырой атмосфере получение такой смеси может произойти очень быстро. При закупорке барабанов с неостывшим карбидом кальция происходит частичное поглощение азота, вследствие чего повышается содержание кислорода в воздухе, присутствующем в барабане. В ходе практических исследований установлено, что в некоторых случаях находящийся в них воздух содержал до 26% кислорода, что значительно повышает взрывоопасность ацетилено-воздушной смеси.
Также опасность представляет наличие в карбиде кальция ферросилиция. Удар стальным зубилом по ферросилицию и даже удар друг о друга кусков ферросилиция являются источником образования искры и, как следствие, оказаться причиной взрыва.
Присутствие ферросилиция объясняется наличием загрязняющих примесей в исходном сырье для получения карбида кальция (железа в коксе и кремнокислоты в извести), а также переходом в шихту железа, из которого изготовлен кожух электрода и др.
Очистку карбида кальция от ферросилиция осуществляют при помощи специальных электромагнитных сепараторов. Данный способ не гарантирует полную очистку поскольку куски ферросилиция, находящиеся внутри больших кусков карбида кальция, остаются неизвлечёнными, а затем, находясь уже в барабане, освобождаются от обволакивающей их оболочки карбида кальция. Необходимо учитывать, что ферросилиций, содержащий более 30% кремния, не обладает магнитными свойствами.
Химические свойства
Немаловажное значение имеют и химические свойства. Они также учитываются при применении материала
К основным характеристикам можно отнести следующие качества:
- Карбид кальция характеризуется тем, что хорошо впитывает влагу. Стоит учитывать, подобная процедура проявляется яркой химической реакцией, связанной с разложением вещества.
- При работе с рассматриваемым материалом стоит учитывать, что образующаяся пыль оказывает раздражительный эффект на слизистые органы. Кроме этого, подобная реакция может проявится при попадании кристаллов или пыли на поверхность кожи. Именно поэтому при работе с рассматриваемым соединением следует использовать респиратор и некоторые другие средства защиты.
- Кристаллы активное реагируют на воздействие других веществ зачастую только при нагреве. При этом может образоваться карбонат кальция.
- В некоторых случаях проводится соединение кристаллического вещества с азотом, в результате чего получается цианамид кальция.
- При нагреве может проходить реакция с мышьяком и хлором, а также фосфором.

Карбонат кальция
Считается, что наиболее важным химическим качеством является податливость к разложению при воздействии воды.
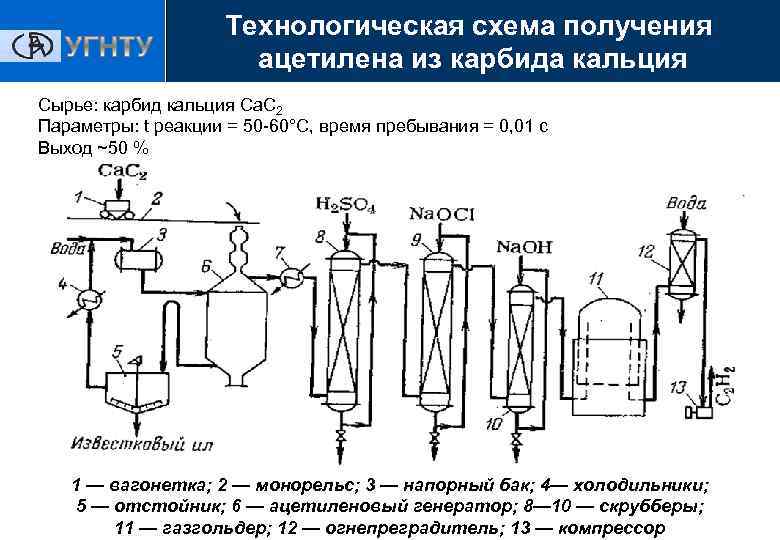
Получение
Как ранее было отмечено, карбид кальция активно применяется при получении самых различных материалов. Именно поэтому процесс получения карбида кальция постоянно совершенствовался. К особенностям применяемых технологий можно отнести нижеприведенные моменты:
- В качестве сырья применяется негашеная известь. В большинстве случаев вещество получается из извести, но в домашних условиях провести подобную процедуру сложно.
- Известь смешивается с измельченном коксом для получения однородной массы.
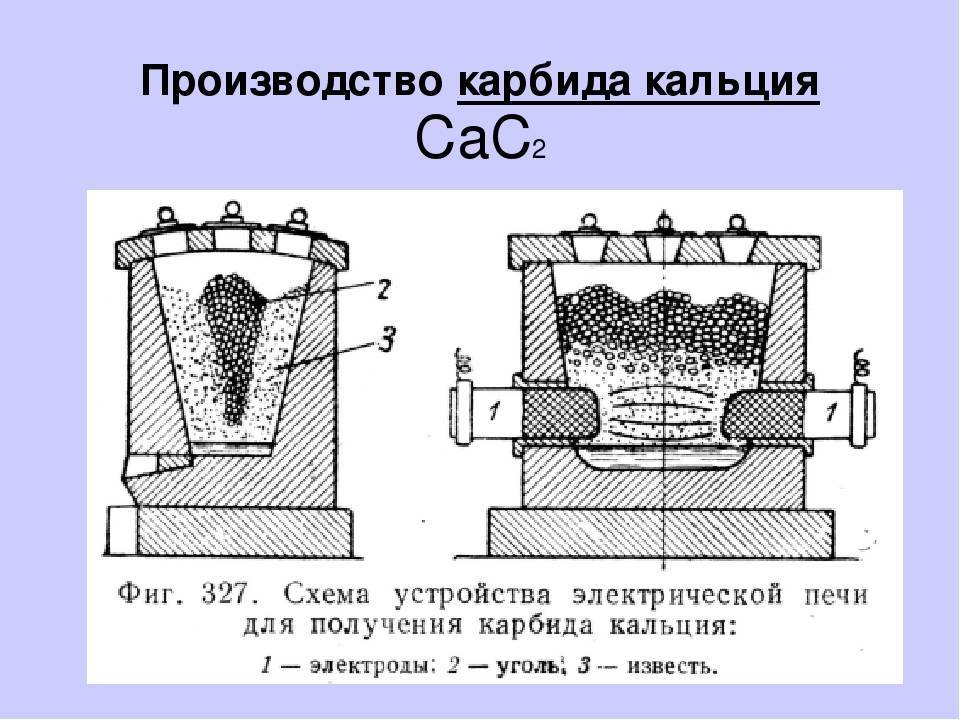
- В промышленности карбид кальция получают по схеме, которая предусматривает нагрев вещества до высокой температуры. Для этого применяются электронные печи. Рекомендуемая температура плавления составляет 1900 ⁰С.
- После нагрева вещества до столь высокой температуры оно переходит в жидкое состояние. Для работы подготавливаются специальные формы.
При рассмотрении того, как из углерода получить карбид кальция отметим, что по установленным стандартам в состав должно входить не менее 80% основного вещества. На долю примесей должно приходится не более 25%, в число которых также входит углерод. Производство оксида кальция также приводит к выделению тепловой энергии, что стоит учитывать.
Лабораторный опыт получения ацетилена
Многим из школьных уроков химии знакома реакция взаимодействия карбида с водой. Обычно этот опыт позволяет продемонстрировать реакцию получения ацетилена, а также физические и химические его свойства. Процесс выделения газа при этом происходит достаточно бурно, поэтому трубка, отводящая ацетилен из колбы с действующими веществами, помещается в чашу с водой. Это обеспечивает менее активное и стремительное движение газа. Кроме того, в лабораторных условиях можно использовать и другой способ, чтобы сделать не слишком бурной реакцию разложения такого соединения, как карбид. Ацетилен при этом идет равномерно и спокойно. Для этого вместо воды необходимо взять насыщенный раствор поваренной соли
Также в лаборатории при проведении этой реакции следует осторожно добавлять воду в карбид, помещенный в объемную колбу, а не наоборот
Что такое «карбид», знает любой мальчишка. Если бросить кусочек карбида в лужу, то кроме дикого шипения получается еще дичайшая вонь. А как получается сам карбид?
Вообще карбидов существует множество, как и применений ему. Но нас пока интересует карбид кальция CaC 2 — то есть тот, который используют для получения ацетилена при соединении карбида с водой.
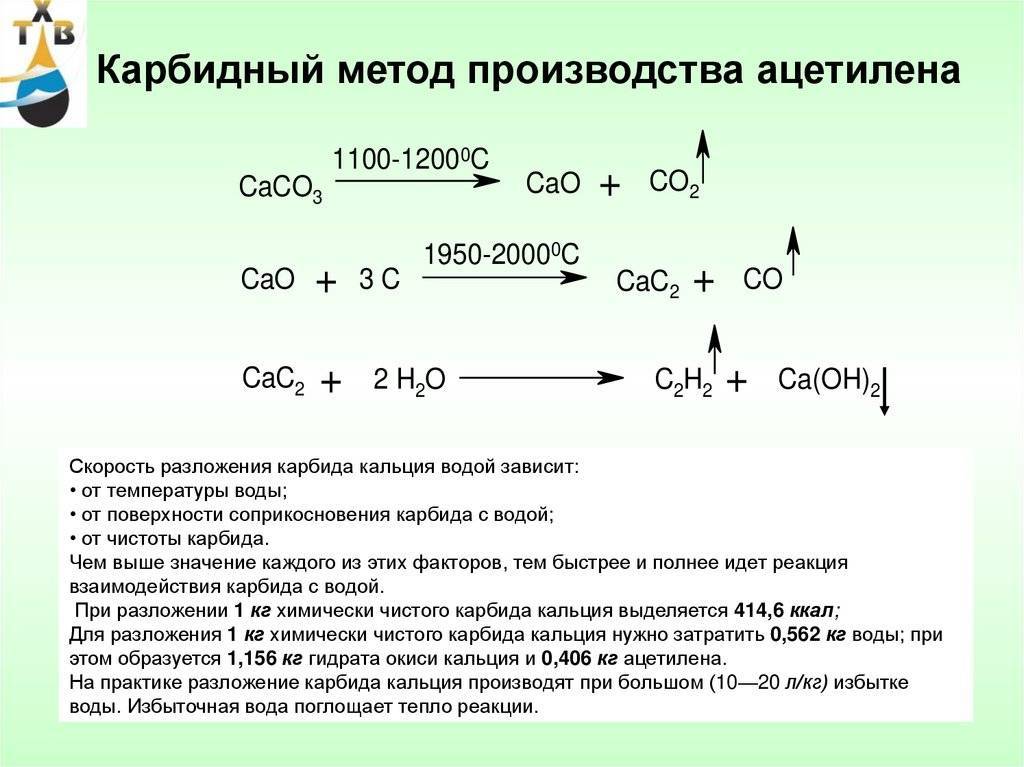
Слишком сложного в получении карбида кальция нет. Сейчас для этого в электропечах пережигают негашеную известь с коксом. При всей этой простоте — впервые карбид кальция был получен в лаборатории в 1836-м году, а промышленно его начали получать в 1892 году. Для попаданца — широчайшее поле для внедрения!
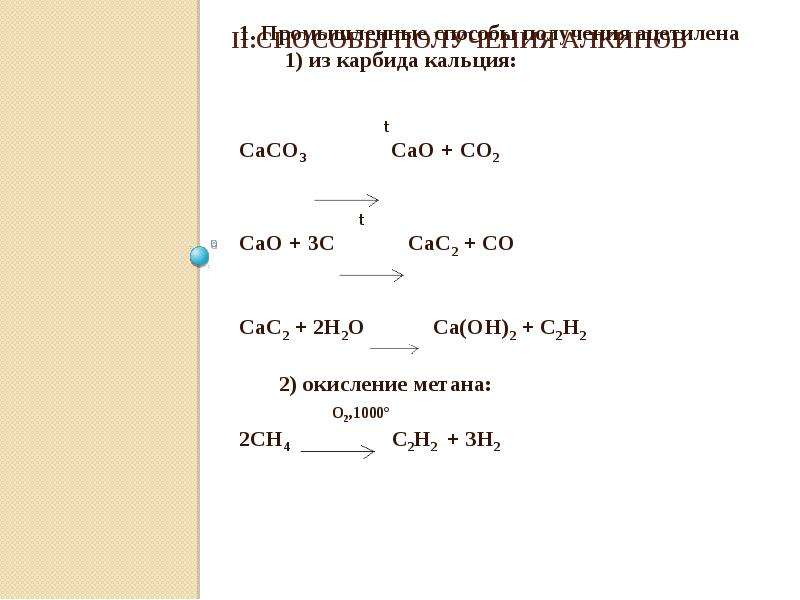
Все реакция — CaO + 3C = CaC 2 + CO
Негашеная известь соединяется с углеродом. Негашеную известь получали с древних времен, пережигая известняк, ну и древесный уголь тоже дефицитом не был никогда. Полученный попутно угарный газ (СО) окисляется до углекислого газа прямо при выходе из печи, хотя сейчас часто печи делают закрытыми для сбора угарного газа.
На 100 весовых частей негашеной извести нужно 70-80 весовых частей углерода.
При производстве лучше иметь избыток угля, чем извести — такой карбид отдает больше ацетилена.
Готовый карбид кальция технического качества почти на 80% состоит из самого карбида кальция, 17% — известь, остальное примеси.
Карбид выходит в виде расплава, который после затвердевания измельчают.
Но, несмотря на простоту реакции получения, есть некоторые неприятные нюансы.
Главное — процесс этот эндотермический, он поглощает дикое количество тепла в процессе производства — 3000 кВт на тонну продукта. Именно из-за этого его делают электродуговым способом. При этом сам процесс идет в жидкой фазе — то есть расплавленная известь постепенно реагирует с кусками углерода. При этом нужна температура примерно 2000°С, что совсем немало. И что совсем неприятно — при перегреве до 2200-2400°С карбид кальция распадается на составляющие.
Поэтому, если нам не доступно электричество в больших объемах, у нас есть два выхода.
Первый — это плавить в тигле. Проблема в том, что тигель должен выдержать эти самые 2000°С, а в древние времена ни графитовый, ни вольфрамовый тигель нам будут недоступны.
Второй — построить небольшую доменную печь. Требуемое тепло даст избыточное количество угля. Уголь и известь насыпаются туда слоями и печь поддувается большим количеством воздуха. Такие печи пытались строить и главная проблема — поддержка точных условий реакции, что регулируется силой поддува.
С одной стороны — такую печь можно построить только когда уже работают доменные печи для железа. А с другой стороны — а нам точно нужен карбид, если нет даже железа?
Трудность вызовет хранение карбида. Он должен быть абсолютно изолирован от воды — много лучше, чем порох. Потому что если порох намокнет, то он не взорвется, а если намокнет карбид — то взрыв обеспечено. И что хуже всего — при хранении не должна использоваться медь, серебро или золото.
Проблем с производством карбида будет немало. Но при каком производстве их будет мало?
Зато все проблемы — решаемые чуть ли не с технологиями Древнего Египта.
А пользы от карбида будет много…
И последнее — ацетилен, который получается после контакта карбида с водой — ничем не пахнет, человек просто не имеет обонятельных рецепторов для него. Та вонь, по которой мы безошибочно определяем карбид — это примеси, которых в техническом карбиде несколько процентов.
Приложения
Производство ацетилена
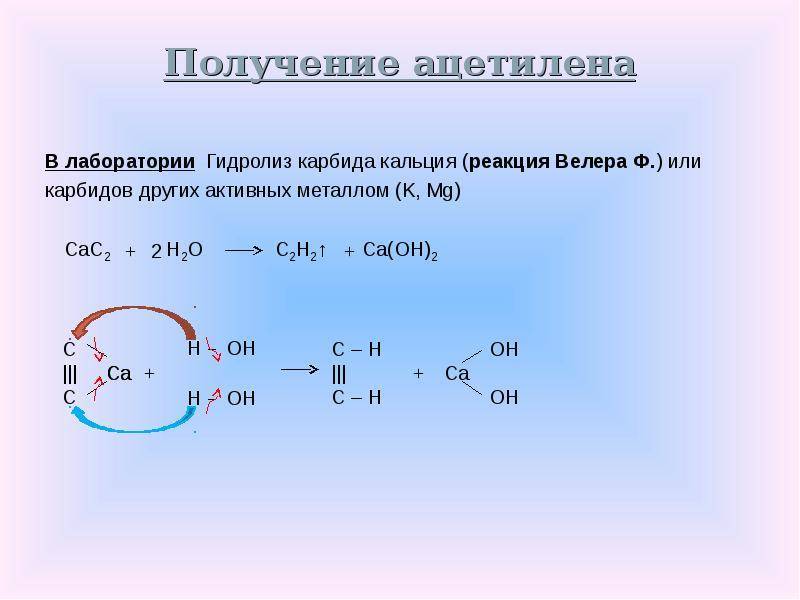
Реакция карбида кальция с водой с образованием ацетилена и гидроксида кальция была открыта Фридрихом Велером в 1862 году.
- СаС 2 ( с ) + 2Н 2 O ( водно ) → С 2 Н 2 ( г ) + Са (ОН) 2 (водно)
Эта реакция легла в основу промышленного производства ацетилена и является основным промышленным применением карбида кальция.
Сегодня ацетилен в основном производится путем частичного сжигания метана или появляется как побочный продукт в потоке этилена при крекинге углеводородов. Таким образом ежегодно производится около 400 000 тонн (см. « ).
В Китае ацетилен, полученный из карбида кальция, остается сырьем для химической промышленности , в частности для производства поливинилхлорида . Ацетилен местного производства более экономичен, чем использование импортного масла. Производство карбида кальция в Китае увеличивается. В 2005 году добыча составила 8,94 миллиона тонн при мощности производства 17 миллионов тонн.
В США, Европе и Японии потребление карбида кальция в целом снижается. Уровень производства в США в 1990-е годы составлял 236 000 тонн в год.
Производство цианамида кальция
Карбид кальция реагирует с азотом при высокой температуре с образованием цианамида кальция :
- CaC 2 + N 2 → CaCN 2 + C
Цианамид кальция, широко известный как нитролим , используется в качестве удобрения. Гидролизуется до цианамида , H 2 NCN.
Сталеплавильное производство
Карбид кальция используется:
- при обессеривании чугуна ( чугун , чугун и сталь)
- в качестве топлива в сталеплавильном производстве для увеличения доли брака в жидком чугуне, в зависимости от экономических соображений.
- как мощный раскислитель на ковшовых очистных сооружениях.
Карбидные лампы
Горит карбидная лампа
Карбид кальция используется в карбидных лампах . При попадании капель воды на карбид образуется газ ацетилен, который горит и дает свет. Хотя эти лампы давали более устойчивый и яркий свет, чем свечи, они были опасны в угольных шахтах, где горючий газ метан представлял серьезную опасность. Наличие горючих газов в угольных шахтах привело к появлению ламп безопасности шахтеров, таких как лампа Дэви , в которой проволочная сетка снижает риск воспламенения метана. Карбидные лампы по-прежнему широко использовались на сланцевых , медных и оловянных рудниках, где метан не представлял серьезной опасности. Большинство шахтерских ламп теперь заменено электрическими лампами .
Карбидные лампы все еще используются для добычи полезных ископаемых в некоторых менее богатых странах, например, на серебряных рудниках недалеко от Потоси , Боливия . Карбидные лампы все еще используются некоторыми спелеологами, исследующими пещеры и другие подземные области, хотя их все чаще заменяют светодиодными .
Карбидные лампы также широко использовались в качестве фар в ранних автомобилях, мотоциклах и велосипедах, но были полностью заменены электрическими лампами.
Другое использование
Карбид кальция иногда используется в качестве источника газообразного ацетилена, который является созревающим агентом, подобным этилену . Однако в некоторых странах это запрещено законом, поскольку при производстве ацетилена из карбида кальция загрязнение часто приводит к образованию следов фосфина и арсина
Эти примеси можно удалить, пропустив ацетиленовый газ через подкисленный раствор сульфата меди , но в развивающихся странах этой мерой предосторожности часто пренебрегают.
Карбид кальция используется в игрушечных пушках, таких как Big-Bang Cannon , а также в бамбуковых пушках . В Нидерландах карбид кальция используется в преддверии Нового года для стрельбы из бидонов .
Карбид кальция вместе с фосфидом кальция используется в плавучих самовоспламеняющихся морских сигнальных ракетах , таких как те, которые производятся Ассоциацией защиты морской флоры и фауны Холмса .
Карбид кальция используется для определения влажности почвы. Когда почва и карбид кальция смешиваются в закрытом цилиндре под давлением, содержащаяся в почве вода реагирует с карбидом кальция с выделением ацетилена, давление которого можно измерить для определения содержания влаги.
Карбид кальция продается в коммерческих целях как средство от кротов . При контакте с водой добываемый газ отгоняет кротов.
Производство карбида
Ковалентные и солеобразные соединения получают простым методом. В электрическую печь помещают смесь из дробленого кокса и оксида металла и нагревают. При высоких температурах оксид элемента вступает в реакцию с коксом. При таком способе часть кокса, которая состоит из углерода, соединяется с атомами элемента, входящими в оксид. В результате образуется требуемый карбид и угарный газ. Готовую расплавленную смесь разливают по специальным формам, а после застывания дробят и сортируют по размеру гранул. Несмотря на простоту данного способа, получение карбида с его помощью является довольно энергозатратным, поскольку требует поддержания высоких температур (1600-2500 градусов) на всем протяжении реакции.
Существуют и альтернативные способы получения некоторых видов веществ. Как правило, это разложение соединения в результате которого и получается требуемый элемент. Формула распада будет отличаться в зависимости от конкретного соединения.
Ацетиленид
Образование ацетиленидов характерно лишь для тех производные ацетилена, которые содержат хотя бы 1 водородный атом у любого из углеродных атомов, соединенных тройной связью.
Реакция ацетиленидов с ортомуравьиными эфирами дает ацетали ( ср.
Образование ацетиленидов характерно лишь для тех производных ацетилена, которые содержат хотя бы 1 водородный атом у любого из углеродных атомов, соединенных тройной связью.
| Условное изображение связи в системах М — CsX, где X О. N или CR. Показана только я-связь в плоскости кг. Аналогичное перекрывание имеется в плоскости уг. Ср. с описанием связи М — Этилен ( 4. |
Большинство комплексных ацетиленидов взрывчато и, как и следовало ожидать, более лабильно, а некоторые легко гидроли-зуются.
Реакция ацетиленидов натрия с первичными алкилгалогенидами ( разд.
Образование ацетиленидов металлов рассматривается в разделах 2 — 5, а продуктов присоединения металлических соединений и производных — в разделах 6 — 10 этой главы.
Осадки ацетиленидов меди, собранные с внутренних поверхностей пружинных трубок 130 манометров, приводились в контакт с ацетиленом при различных давлениях. Ацетилениды, собранные на поверхности фосфористой бронзы, содержащей 93 % меди, показали признаки распада при испытании на удар с нагрузкой 0 5 кгс.
Из ацетиленидов указанных металлов при действии веществ кислотного характера, особенно галоидоводо-родных кислот и сероводорода, выделяется ацетилен. Байер первый использовал раствор цианистого калия для выделения диацетилена из его медной соли.
Возможность получения ацетиленидов указанным способом, повидимому, связана со специфическими свойствами перечисленных выше металлов. Для солей других металлов образование ацетиленидов в водных и спиртовых растворах не происходит. Дюран , например, не смог получить осадков ацетиленидов из гидратов окиси свинца, никеля и кобальта в водных щелочных растворах.
Для окисления ацетиленидов меди ( I) в качестве окислителя более эффективен гексацианоферрат ( III) калия Кз в ДМЭ или ДМФА. В 1959 г. Эглинтон предложил значительно более удобную модификацию окислительной коиденсации алкинов. Алкин окисляют ацетатом меди ( II) в растворе пиридина при 60 — 70 С. Модификация Эглинтона оказалась чрезвычайно полезной для синтеза макроцикличеких полиинов нз а ю-днииов.
Заметные количества ацетиленидов серебра, меди, ртути получаются при реакции ацетилена с растворами солей металлов. Очищенный от примесей ацетилен и чистые металлы в реакцию практически не вступают. Технический ацетилен, особенно получающийся при карбидном способе производства, содержит в виде примесей фосфористый водород, аммиак, пары воды и др. Сам ацетилен обладает свойствами слабой кислоты. Поэтому при длительном соприкосновении технического ацетилена с металлами возможно образование ацетиленидов.
Окислительное сочетание ацетиленидов меди ( а также ацетиленидов других металлов) следует отличать от реакций олигомеризации, которые алкины претерпевают в присутствии ионов Си в кислой среде.
Обычно взаимодействие ацетиленидов меди с нуклеофильными реагентами осуществляют в среде пиридина или диметилформамида, реже — в среде анизола, однако ацилирование ацетиленидов меди хлорангидридами в этих растворителях не протекает. Так, при взаимодействии фенилацетиленида меди с бензоилхлоридом или терефталилхлоридом в пиридине образуется растворимый комплекс, который при разложении водой выделяет исходный ацет иленид меди. Те же результаты были получены при взаимодействии ацетиленидов меди с ацетилхлоридом.
При действии ацетиленидов лития и натрия в жидком аммиаке на хлористый бензил вместо ожидаемого бензил-ацетилена были выделены CflH СН ( СН.
Свойства
Физические свойства
- Бесцветные тетрагональные кристаллы.
- Плотность: 228 (+20 °C, г/см3).
- Удельная теплоёмкость при постоянном давлении (в Дж/г·K): 0,92 (+20—325 °C).
- Стандартная энтальпия образования ΔfH (298 К, кДж/моль): −62,8 (т).
- Стандартная энергия Гиббса образования ΔfG (298 К, кДж/моль): −67,8 (т).
- Стандартная энтропия образования S (298 К, Дж/моль·K): 70,3 (т).
- Стандартная мольная теплоёмкость Cp (298 К, Дж/моль·K): 62,34 (т).
- Энтальпия плавления ΔHпл (кДж/моль): 32,2.
- Карбид кальция имеет резкий чесночный запах.
Химические свойства
При взаимодействии c водой карбид кальция гидролизуется с образованием ацетилена и гидроксида кальция (гашёной извести):
Представленная выше реакция является экзотермической.
Точка кипения
ЦК2 кипит при 2300ºC с разложением. Точку кипения необходимо измерять в инертной атмосфере, то есть без кислорода и влаги.
Физиологическое действие
- Среди всех неорганических производных кальция CaC2 очень ядовит.
- По степени воздействия на организм человека карбид кальция относится к 1-му классу опасности согласно ГОСТ 12.1.007.
- Попадание карбида кальция внутрь организма также является опасным.
- Пыль карбида кальция оказывает раздражающее действие на кожу, слизистые оболочки органов дыхания.
- Карбид кальция CaC2 чрезвычайно опасен для окружающей среды.
Состав и виды карбидов
Карбиды не являются отдельным веществом. Это соединение углерода с металлами и неметаллами. Причем, следует учитывать, что углерод должен обладать большей электроотрицательностью в получаемом веществе по сравнению с другими используемыми элементами. Это дает возможность избежать производства галогенов, оксидов и других углеродных соединений.
На сегодняшний день различают три вида карбида, состав которых отличен друг от друга:
- Ковалентные соединения. К данному виду относят два элемента — кремний и бром. Это соединения с прочной межатомной связью, что обеспечивает высокую температуру плавления и химическую инертность. Окисление веществ данной группы возможно только при их нагреве свыше 1000 градусов Цельсия. Твердость вещества с бромом настолько высока, что способна конкурировать даже с алмазами. Вещество с кремнием менее прочное, но 8 баллов по шкале Мооса имеет. При этом растворить данное вещество возможно только в царской водке или с помощью концентрированной азотной или плавиковой кислоты.
- Ионные соединения или солеобразные. Вещества данной группы образуются с помощью металлов 1 и 2 группы таблицы Менделеева, а также алюминием. Данные соединения характеризуются высокой температурой плавления. Карбиды ионного вида распадаются под воздействием воды и кислот. При протекании реакции выделяется углеводород и остается гидроксид металла.
- Ионно-ковалентно-металлические или металлоподобные соединения. Образуются с помощью металлов с 4 по 8 группу, а также кобальтом, никелем и железом. Отличительная особенность металлоподобных веществ — это высокая прочность и температура плавления. Данный вид соединений делится на два типа:
- Ацетилениды — при гидролизе образуют этин или ацетилен. Карбид кальция относится к данному типу соединений.
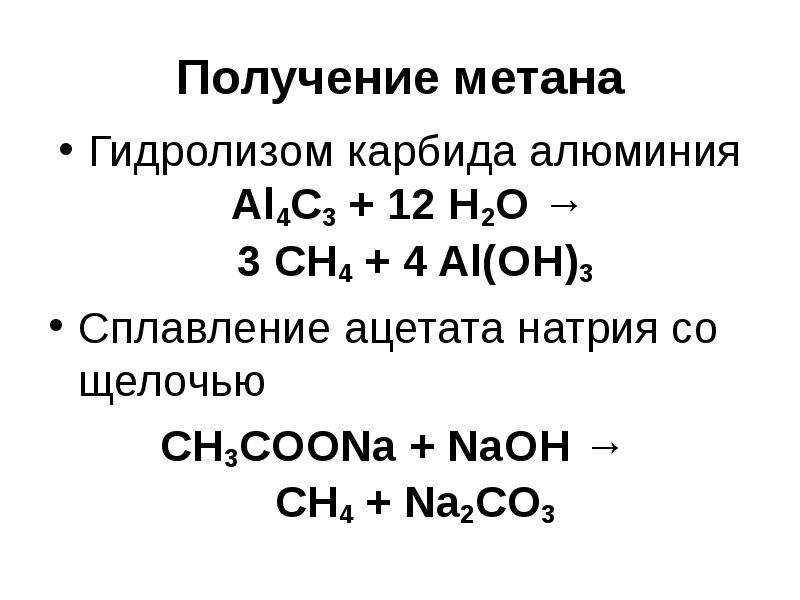
- Метаниды — при вступлении в реакцию с водой или разбавленными кислотами образуют метан. Чаще бесцветны. Сюда относят карбид алюминия, магния, бериллия.
Читать также: Коронка для мебельных петель
История получения
Карбид кальция – соединение, получившее широкое применение в современной промышленности. В 1862 году немецкий химик Фридрих Велер впервые синтезировал молекулу этого вещества. Получение карбида кальция он осуществил следующим образом. Ученый приготовил расплав кальция с цинком, а затем нагрел его с углем. В результате получился карбид. Химическая формула соединения – CaC2. Промышленный способ получения карбида предложил ученый Муассан в 1892 году. Другие названия вещества – ацетиленид кальция, или углеродистый кальций. Кристаллическая решетка соединения выглядит следующим образом:
Техника безопасности при работе с карбидом кальция.
Как уже Вам известно, карбид кальций — это взрывоопасное вещество и для обеспечения безопасной работы с ним необходимо выполнять несколько обязательных правил при использовании карбида для сварки. Главные положения, которые необходимо выполнять при сварочных работах на основе карбида кальция:
Учитывайте, что карбид кальция активно взаимодействует с воздухом и водой, выделяя легковоспламеняющийся ацетиленовый газ
Место хранения карбида для сварки должно быть сухим и герметичным.
Карбид кальция также взрывоопасен, поэтому искры и открытый огонь рядом с веществом строго воспрещены.
Пыль карбида (куски менее 2 мм) вызывают раздражения, попадая на кожу, глаза и слизистую оболочку рта, и носа.
Регулярные сварочные работы с применением карбида кальция должны проводиться в специально оборудованном для сварки помещении, в котором нет горючих веществ, и присутствуют только несгораемые материалы
Жизненно важно, чтобы все оборудование, связанное с хранением и производством ацетилена было изолировано в отдельных отсеках сварочной мастерской, а само помещение для генераторов должно легко проветриваться и в случае чего деактивироваться.
Установка генераторов ацетилена строго запрещена в подвальных комнатах.
После завершения сварочных работ с применением карбида кальция как «топлива», в генераторах все оставшееся вещество дорабатывается, и полученные шлаки в виде известкового ила удаляем из генератора в специальную яму или бункер.
Напомним, что карбид и ацетилен — взрывоопасные вещества. Поэтому курение, открытый огонь на расстоянии до 10 метров от места хранения отработанного карбида строго воспрещено.
При перевозке и хранении ацетиленовых баллонов, на конструкцию клапанов должны быть навинчены предохранительные колпаки
Толчки и удары при транспортировке нескольких баллонов смертельно опасны. Хранение и перевозка ацетиленовых баллонов с другими веществами не допустима.
И напоследок отметим, что карбид кальция является высокоинтенсивным веществом для получения ацетиленового газа, что сводит к минимуму его расход. Кроме того, один килограмм ацетилена, полученного из карбида кальция, выделяет тепла около 8 тысяч кДж.
Карбиды — это соединения металлов и неметаллов с углеродом. Обычно в таких соединениях углерод имеет большую электроотрицательность, чем второй элемент, что позволяет исключить из группы оксиды, галогены и другие углеродные соединения.
Это твердые тугоплавкие вещества, нелетучие и нерастворимые. В основном они обладают разнообразными свойствами: некоторые, например, карбид золота, может взорваться при попытке пересыпать его, а некоторые из соединений, например, бора, циркония, титана, кремния и вольфрама, по твердости превосходят алмаз и не поддаются действию кислот и растворителей.
Это интересно: Что такое курвиметр — характеристики и назначение прибора
Применение
Область применения карбида кальция чрезвычайно широка. В первую очередь это промышленный синтез. Карбид кальция используется для производства синтетического каучука, уксусной кислоты, ацетона, этилена, винилхлорида, стирола. Также он находит применение в получении цианамида кальция. Это вещество ценно своим использованием в синтезе различных удобрений и цианистых веществ. В сельском хозяйстве любому агроному известно такое название, как карбидно-карбамидный регулятор. Он применяется для регуляции роста растений. А для его получения также используется карбид кальция. Кроме того, это соединение находит применение в процессе производства цианамида кальция. Эта реакция основана на нагревании карбида кальция с азотом. Восстановление щелочных металлов также не обходится без применения описываемого нами вещества. Карбид кальция применяется и в процессе газосварки. Например, широко используются карбидные лампы. Принцип их работы основан на взаимодействии в специальной емкости карбида с водой и сгорании на выходе из аппарата конечного вещества реакции – ацетилена. Посмотрите на фото карбидной лампы.

Историческая справка
Первое необычное углеродное соединение, похожее на карбид, было получено в начале XIX века англичанином Дэви. Это был карбид калия. Далее в 1863 году был найден неустойчивый карбид меди, через 15 лет — карбид железа.
Официально соединения «появились» только в конце XIX века — к ним приложил руку француз Анри Муассон. Он получал соединения при помощи вольтовой дуги в электрической печи, которую он сам и придумал. Для этого использовались нагретый до раскаленного состояния древесный уголь, чистые металлы и их оксиды.
Однако за несколько лет до Муассона в метеоритах был обнаружен минерал когенит — смесь карбидов кобальта, железа и никеля. В некотором смысле эта находка помогла ответить на вопрос «Что такое карбиды?».