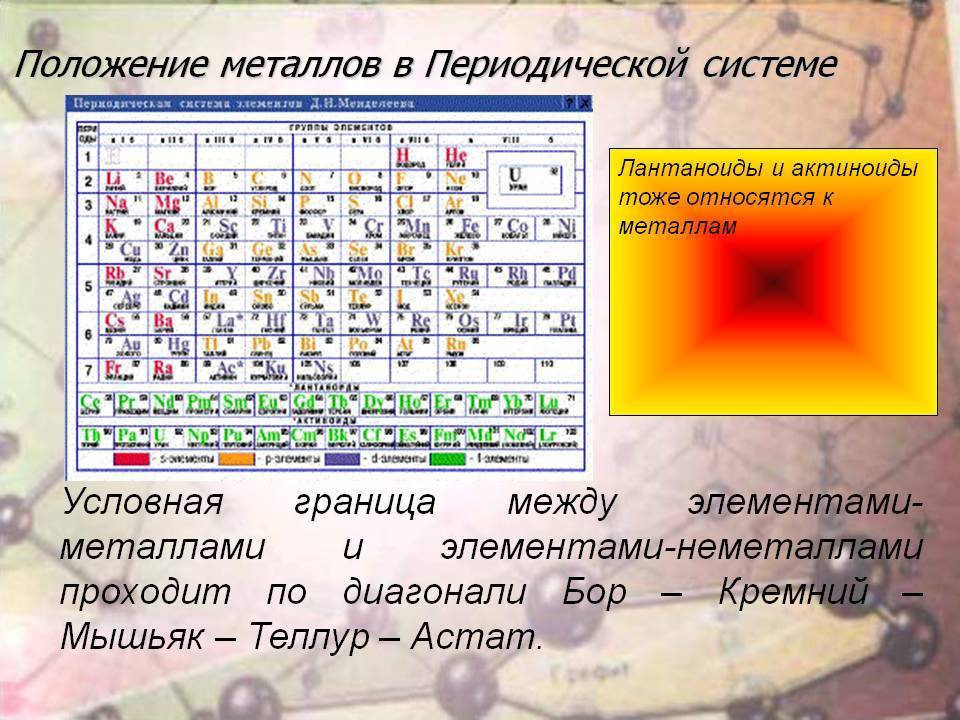
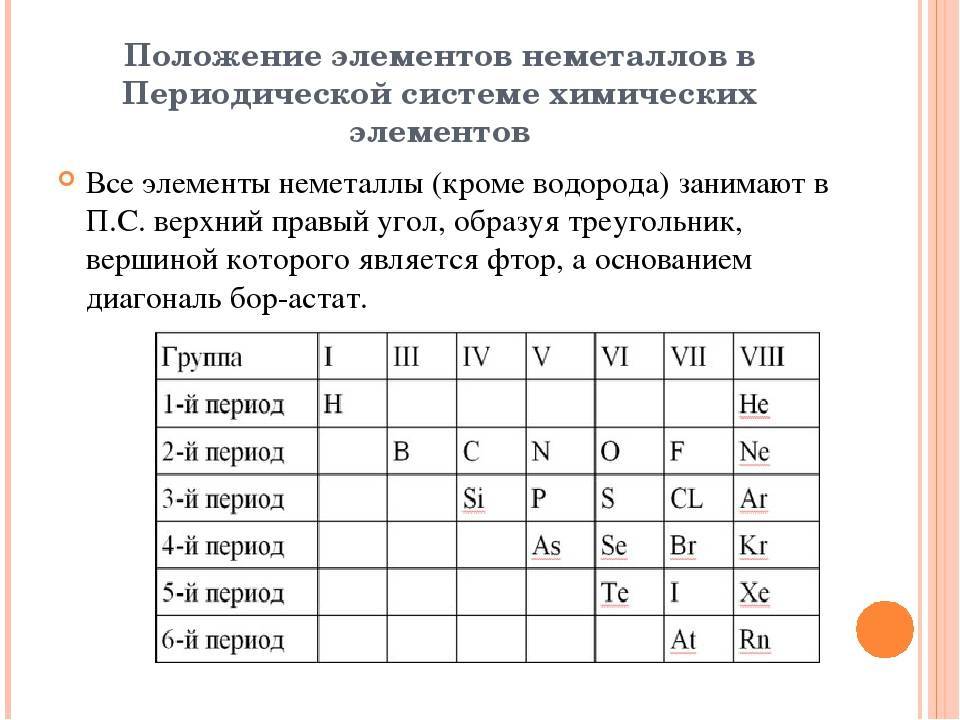
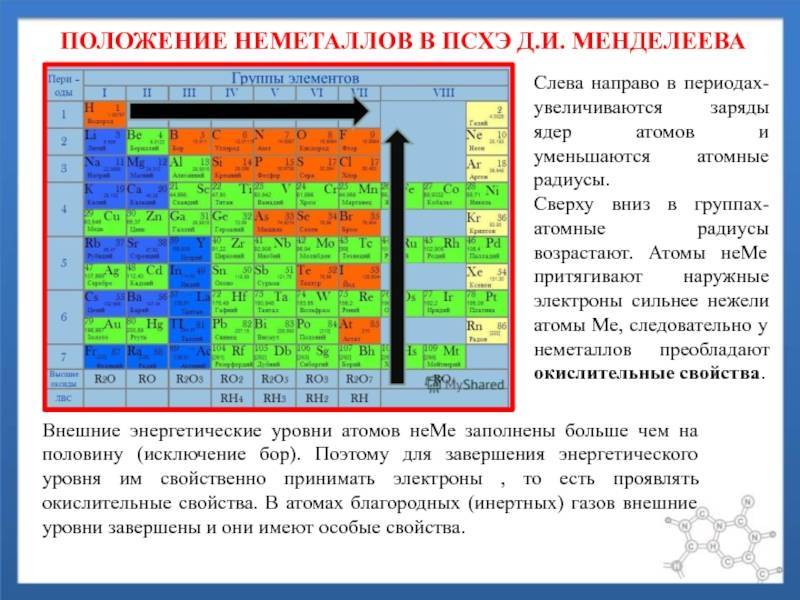
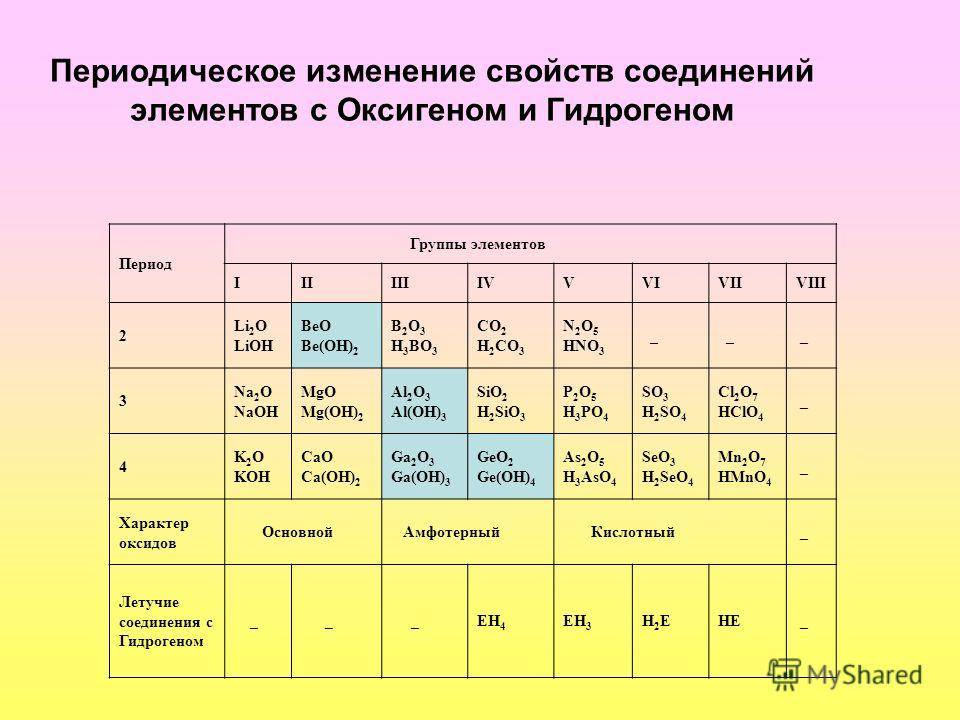
Лантан без лантаноидов
Как ни грустно сознавать, герой нашего рассказа — личность вполне заурядная. Это металл, обыкновенный по внешнему виду (серебристо-белый, покрытый сероватой окисной пленкой) и по физическим свойствам: температура плавления 920, кипения 3469° С; по прочности, твердости, электропроводности и прочим характеристикам металл лантан всегда оказывается в середине таблиц. Обыкновенен лантан и по химическим свойствам. В сухом воздухе он не изменяется — окисная пленка надежно защищает от окисления в массе. Но если воздух влажен (а в обычных земных условиях он влажен почти всегда), металлический лантан постепенно окисляется до гидроокиси. La(OH)3 — основание средней силы, что опять-таки характерно для металла-«середнячка».
церий
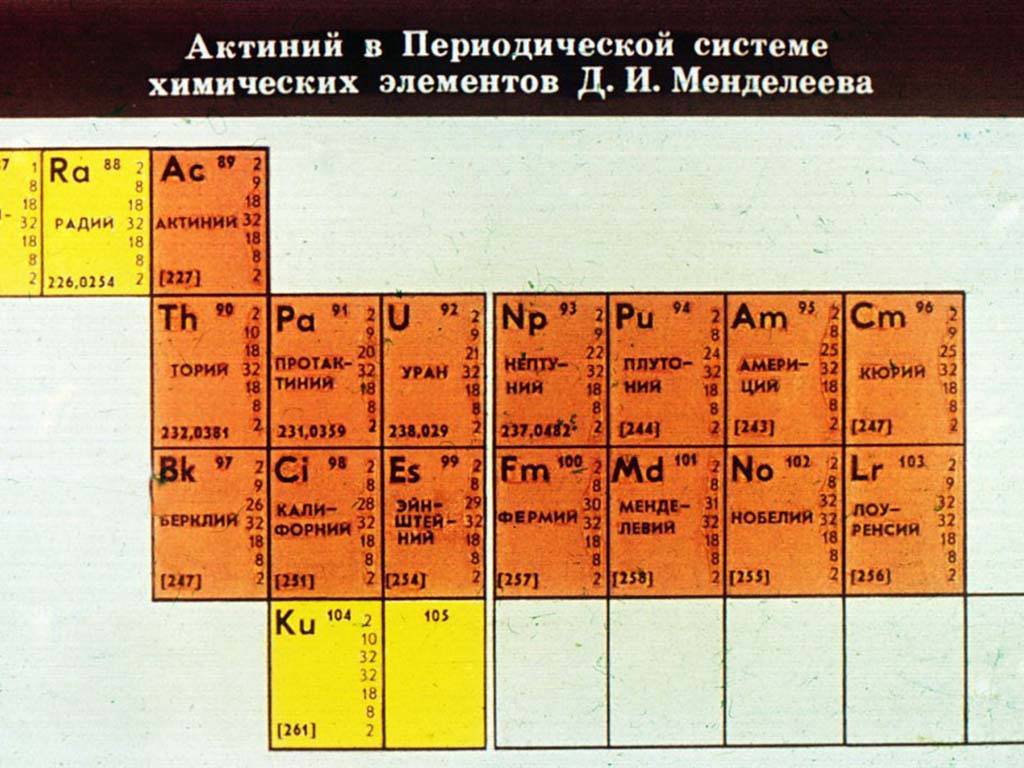
Новый элемент, обнаруженный в церите и мозандерите, по предложению Берцелиуса назвали лантаном. Название с намеком: оно происходит от греческого A,av0dveiv — скрываться, забываться. Лантан, содержащийся в церите, успешно скрывался от химиков в течение 36 лет! Долгое время считали, что лантан двухвалентен, что он аналог кальция и других щелочноземельных металлов, а его атомный вес равен 90—94. В правильности этих цифр не сомневались до 1869 г. Менделеев же увидел, что во II группе периодической системы редкоземельным элементам нет места и поставил их в III группу, приписав лантану атомный вес 138—139. Но правомерность такого перемещения еще надо было доказать. Менделеев предпринял исследование теплоемкости лантана. Полученная им величина прямо указывала на то, что этот элемент должен быть трехвалентным… Металлический лантан, разумеется, далеко не чистый, впервые был получен Мозандером при нагревании хлористого лантана с калием. В наше время в промышленных масштабах получают лантан чистотой более 99%. Проследим, как это делается, но прежде познакомимся с главными минералами лантана и первыми стадиями сложнейшего процесса разделения редкоземельных элементов. Уже упоминалось, что в минералах лантан и лантаноиды неизменно сопутствуют друг другу. Есть минералы селективные, в которых доля того или иного редкоземельного элемента больше, чем обычно. Но нет минералов чисто лантановых или чисто цериевых, не говоря уже о других лантаноидах. Примером селективного лантанового минерала может служить давидит, в котором до 8,3% Lа203 и лишь 1,3% окиси церия. Но получают лантан преимущественно из монацита и бастнезита, как, впрочем, и церий, и все остальные элементы цериевой подгруппы. Монацит — тяжелый блестящий минерал, обычно желто-бурый, но иногда и других цветов, поскольку постоянством состава он не отличается. Точнее всего его состав описывает такая странная формула: (РЗЭ)Р04. Она означает, что монацит — фосфат редкоземельных элементов (РЗЭ). Обычно в монаците 50—68% окислов РЗЭ и 22—31,5% Ра05. А еще в нем до 7% двуокиси циркония, 10% (в среднем) двуокиси тория и 0,1—0,3% урана. Эти цифры со всей очевидностью показывают, почему так тесно переплелись пути редкоземельной и атомной промышленности. Смешанный металл редких земель — мишметалл — и смесь их окислов начали применять в конце прошлого века, а в начале нынешнего в связи с ними был /продемонстрирован выдающийся образец международного воровства. Немецкие суда, доставлявшие грузы в Бразилию, собираясь в обратный путь, заполняли трюмы песком с пляжей Атлантического побережья этой страны, причем из определенных мест. Капитаны заявляли, что песок — это просто балласт, необходимый для большей устойчивости судна. В действительности же они, выполняя заказы германских промышленников, крали ценное минеральное сырье — прибрежные пески штата Эспириту-Санту, богатые монацитом… Монацитовые россыпи распространены по берегам рек, озер и морей на всех континентах. В начале века (данные за 1909 г.) 92% мировой добычи редкоземельного сырья, и прежде всего монацита, приходилось на долю Бразилии. Спустя десять лет центр тяжести переместился на тысячи километров к востоку (или к западу, смотря как считать) — в Индию. После 1950 г. в связи с развитием атомной промышленности гегемоном среди капиталистических стран в добыче и переработке редкоземельного сырья стали Соединенные Штаты.
циркона432Кадмий3празеодима
К 1965 г. внешнеторговые организации нашей страны могли предложить покупателям все лантаноиды в виде металлов чистотой выше 99%. Кроме прометия, разумеется, хотя радиоактивные препараты этого элемента — продукты ядерного распада урана — тоже стали вполне доступны. В каталоги «Техснабэкспорта» вошли также около 300 химически чистых и особо чистых соединений лантана и лантаноидов. Это свидетельство высокого уровня развития советской редкоземельной промышленности. Но вернемся к лантану.
Общие способы получения металлов в промышленности
За исключением тория, протактиния и урана, которые добывают прямым путем из руд, остальные актиноиды можно получить путем облучения образцов металлического урана быстродвижущимися потоками нейтронов. В промышленных масштабах нептуний и плутоний добывают из отработанного топлива ядерных реакторов. Отметим, что получение актиноидов – это достаточно сложный и дорогостоящий процесс, основными методами которого являются ионный обмен и многостадийная экстракция. Лантаноиды, которые называют редкоземельными элементами, получают путем электролиза их хлоридов или фторидов. Чтобы добыть сверхчистые лантаноиды, используют металлотермический метод.

Литература
|
Сокращение лантаноидов
→ Основная статья : Сокращение лантаноидов
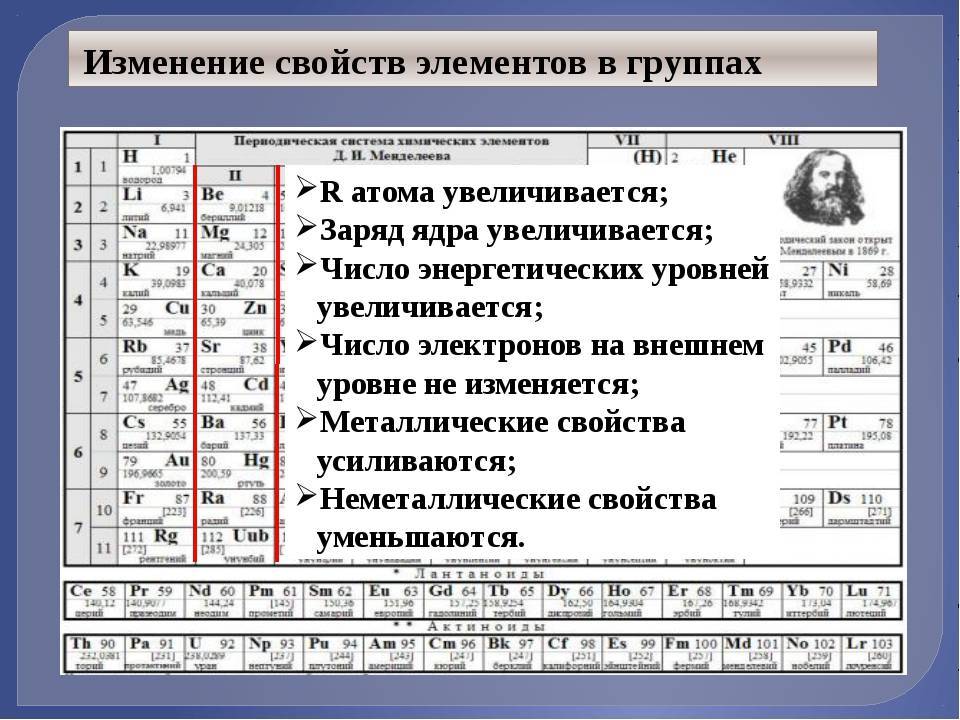
Из-за сжатия лантаноидов атомный радиус почти непрерывно уменьшается в диапазоне от церия (183 мкм) до лютеция (172 мкм) (исключение составляют европий и иттербий). Это связано с тем, что элементы, которые — в зависимости от атомного номера — находятся перед лантаноидами, уже заполнили электронами оболочки 6s и 5p, но не оболочку 4f. Теперь лантаноиды заполняют 4f-оболочку электронами. В упрощенном представлении атома как состоящего из пространственно разделенных электронных оболочек, электронная оболочка, пространственно более близкая к ядру, теперь заполнена носителями заряда. Вдобавок ядро, конечно, заполнено тем же числом протонов, что и электроны, добавленные к 4f-оболочке. В результате более сильное притяжение между электронами и протонами сокращает атомный радиус, в то время как атомный номер увеличивается.
Этот эффект на самом деле не является исключительным, поскольку радиус всегда уменьшается, когда чаша наполняется в течение определенного периода времени. Однако это свойство имеет некоторые последствия:
- Благодаря уменьшающимся размерам легко возможно разделение с помощью ионообменников .
- В гольмии радиус Ln 3+ настолько мал, что почти соответствует радиусу Y 3+ ; поэтому иттрий обычно встречается вместе с «тяжелыми землями».
- Внутри группы переходные элементы во 2-й и 3-й позициях имеют очень похожие свойства.
Получение лантаноидов
Основной способ получения лантаноидов – восстановление металлов из их окислов водородом или другими восстановителями.
А.Н.Даапе и Ф.Спендинг разработали двухстадийный способ получения элементарного диспрозия. Сначала окись диспрозия превращают в фторид, на который затем действуют металлическим кальцием при быстром нагревании:
Dy 2 O 3 + 6HF → 2DyF 3 + ЗН 2 О 2DyF 3 + ОСА 1500 ? C → 3CaF 2 + 2Dy
Такой способ позволяет получать металл высокой чистоты. Тербий получают, восстанавливая Тb 2 О с кальцием или электролизом расплава ТbС1 3. Благодаря внедрению передовых технологий получения лантаноидов, такие, как ионный обмен, зонная плавка, экстракция, получают металлы с высоким выходом и высокой чистоты.
Теоретически с бромида самария можно выделить чистый металл. Однако при взаимодействии с активными металлами основная масса исходного вещества сублимируется:
SmBr 2 + Ва → Sm + ВаВr 2.
Лантан получают из монацита в несколько стадий. Первая стадия концентрации происходит уже на драге. Плотность монацита 4,9-5,3, а привычного песка – в среднем 2,7 г / см 3. При такой разнице в весе гравитационное разделение не представляет особого труда. Но, кроме монацита, в тех же песках есть другие тяжелые минералы. Поэтому чтобы получить монацитового концентрат чистотой 92-96%, применяют комплекс гравитационных, магнитных и электростатических методов обогащения. В результате попутно получают ильменитовый рутил, цирконовые и другие ценные концентраты.
Как и всякий минерал, монацит надо “раскрыть”. Чаще монацитового концентрат обрабатывают для этого концентрированной серной кислотой. Сульфаты редкоземельных элементов и тория, образующиеся выщелачивают обычной водой. После того, как они перейдут в раствор, в осадке остаются кремнезем и часть циркона, не отделилась на предыдущих стадиях.
На следующей стадии разделения извлекают короткоживущих радий-228, а затем и торий – иногда вместе с церием, иногда отдельно. Отделение церия от лантана и смеси Ланта-ноиды не особо сложное: в отличие от них, он способен проявлять валентность 4 + и в виде гидроксида Се (ОН) 4 переходить в осадок, тогда как его трехвалентные аналоги остаются в растворе. Стоит отметить, что операция отделения церия, как, впрочем, и предыдущие, проводится много раз – чтобы как можно полнее “выжать” дорогой редкоземельный концентрат.
После того, как церий, выделенный в растворе всего лантана (в виде нитрата Lа (NO 3) 3, поскольку на одной из промежуточных стадий серная кислота была заменена азотной, чтобы облегчить дальнейшее разделение). Из этого раствора и получают лантан, добавляя аммиак, нитраты аммония и кад-мию. При наличии Сd (NO 3) 2 разделение более полно. С помощью этих веществ все лантаноиды переходят в осадок, в фильтрате же остаются лишь кадмий и лантан. Кадмий облагаются сероводородом, отделяют осадок, а раствор нитрата лантана еще несколько раз очищают дробной кристаллизацией от примесей лантаноидов.
Таким образом, получают хлорид лантана LаС1 3 -. Электролизом расплавленного хлорида дает лантан чистотой до 99,5%. Еще чище лантан (99,79% и выше) получают кальциетермичним способом. Такая традиционная классическая технология.
Периодический закон
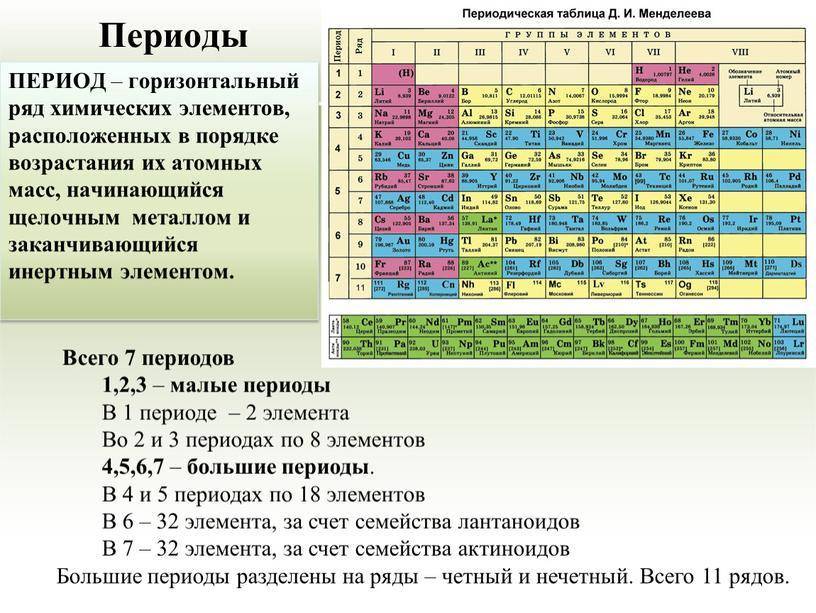
К середине XIX века учёные располагали множеством сведений о физических и химических свойствах разных элементов и их соединений. Появилась необходимость упорядочить эти знания и представить их в наглядном виде. Исследователи из разных стран пытались создать классификацию, объединяя элементы по сходству состава и свойств веществ, которые они образуют. Однако ни одна из предложенных систем не охватывала все известные элементы.
Пытался решить эту задачу и молодой русский профессор Д.И. Менделеев. Он собирал и классифицировал информацию о свойствах элементов и их соединений, а затем уточнял её в ходе многочисленных экспериментов. Собрав данные, Дмитрий Иванович записал сведения о каждом элементе на карточки, раскладывал их на столе и многократно перемещал, пытаясь выстроить логическую систему. Долгие научные изыскания привели его к выводу, что свойства элементов и их соединений изменяются с возрастанием атомной массы, однако не монотонно, а периодически.
Так был открыт периодический закон, который учёный сформулировал следующим образом: «Свойства элементов, а потому и свойства образуемых ими простых и сложных тел, стоят в периодической зависимости от их атомного веса».

Своё открытие Менделеев совершил почти за 30 лет до того, как учёным удалось понять структуру атома. Открытия в области атомной физики позволили установить, что свойства элементов определяются не атомной массой, а зависят от количества электронов, содержащихся в нём. Поэтому современная формулировка закона звучит так:
Свойства химических элементов, а также формы и свойства образуемых ими веществ и соединений находятся в периодической зависимости от величины зарядов ядер их атомов.
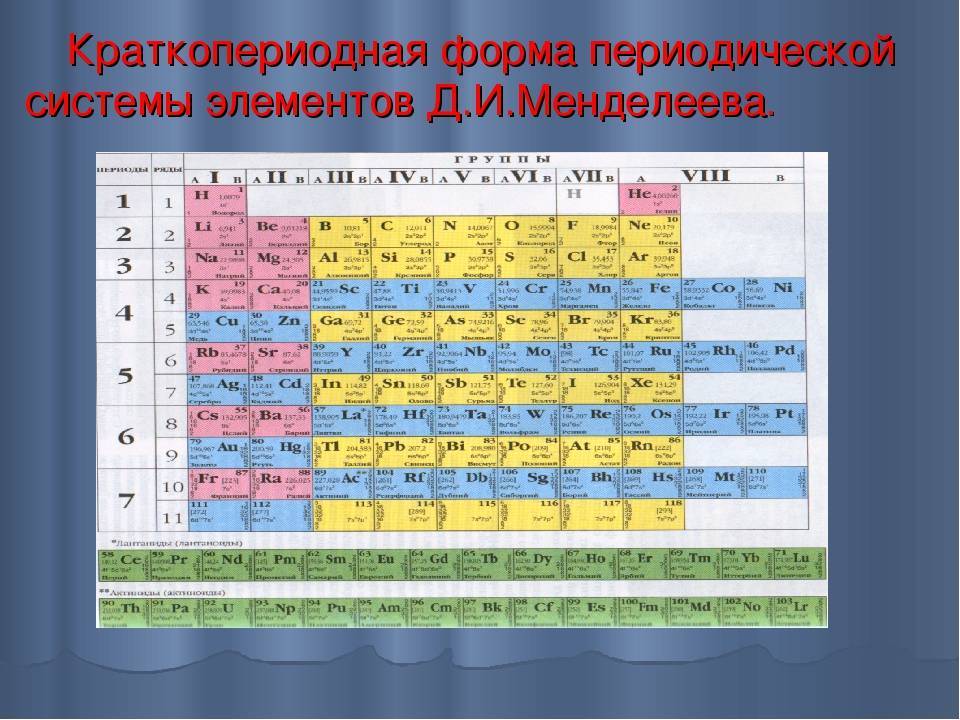
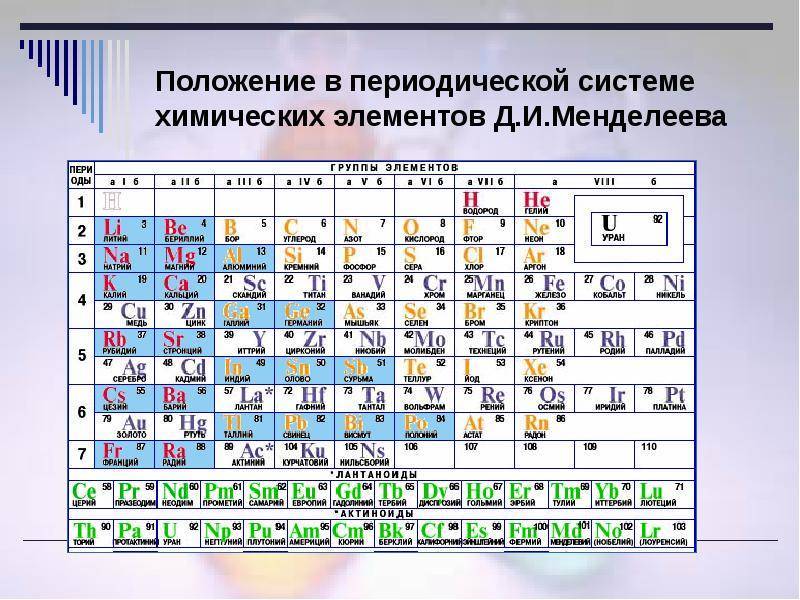
Этот принцип Менделеев проиллюстрировал в таблице, в которой были представлены все 63 известных на тот момент химических элемента. При её создании учёный предпринял ряд весьма смелых шагов.
<<Форма демодоступа>>
Во-первых, многочисленные эксперименты позволили Менделееву сделать вывод, что атомные массы некоторых элементов ранее были вычислены неправильно, и он изменил их в соответствии со своей системой.
Во-вторых, в таблице были оставлены места для новых элементов, открытие которых учёный предсказал, подробно описав их свойства.

Первый вариант Периодической таблицы элементов, составленной Д.И. Менделеевым.
Мировое научное сообщество поначалу скептически отнеслось к открытию русского химика. Однако вскоре были открыты предсказанные им химические элементы: галлий, скандий и германий. Это разрушило сомнения в правильности системы Менделеева, которая навсегда изменила науку. Там, где раньше учёному требовалось провести ряд сложнейших (и даже не всегда возможных в реальности) опытов — теперь стало достаточно одного взгляда в таблицу.
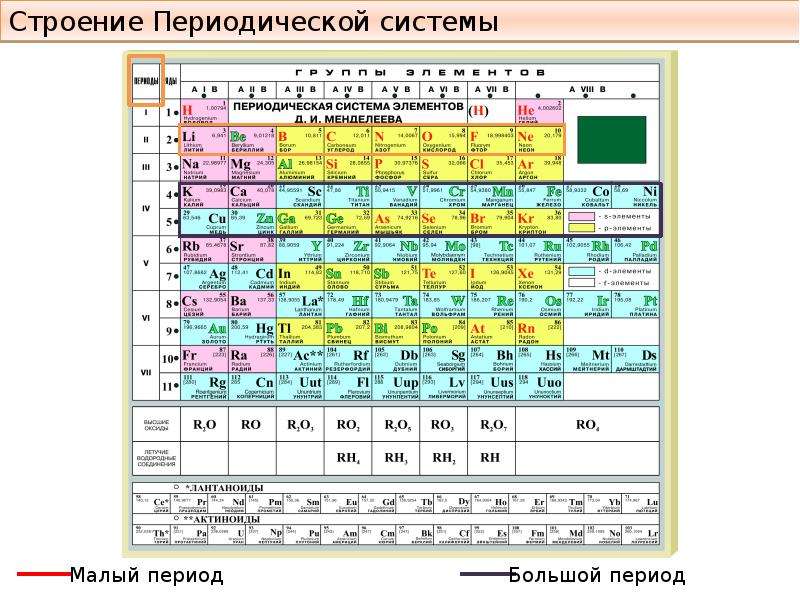
Теперь расскажем, как устроена Периодическая таблица элементов Менделеева и как ею пользоваться.
Металлические свойства
Все представители обеих групп являются металлами, у которых достраиваются 4f-, 5f-, а также d-подуровни. Лантан и элементы его семейства называют редкоземельными. Их физические и химические характеристики настолько близки, что по отдельности в лабораторных условиях они разделяются с большим трудом. Проявляя чаще всего степень окисления +3, элементы ряда лантана имеют много сходных черт со щелочноземельными металлами (барием, кальцием, стронцием). Актиноиды также являются чрезвычайно активными металлами, к тому же еще и радиоактивными.
Особенности строения лантаноидов и актиноидов касаются и таких свойств, как, например, пирофорность в мелкодисперсном состоянии. Наблюдается также уменьшение размеров гранецентрированных кристаллических решеток металлов. Добавим, что все химические элементы обоих семейств – это металлы с серебристым блеском, из-за высокой реакционной способности быстро темнеющие на воздухе. Они покрываются пленкой соответствующего оксида, защищающей от дальнейшего окисления. Все элементы достаточно тугоплавки, за исключением нептуния и плутония, температура плавления которых значительно ниже 1000 °С.
Общие свойства
Это блестящие металлы с серебристым блеском, которые быстро тускнеют на воздухе. По мере увеличения атомного номера они становятся все менее и менее мягкими . Их температура плавления и кипения выше, чем у большинства металлов, за исключением переходных металлов . Они бурно реагируют с большинством неметаллов и горят на воздухе. Это свойство используется в более легких камнях , которые сделаны из сплава лантаноидов, мишметалла .
Эти элементы не редкость в естественной среде, церий 58 Ce является 26- м или 27- м наиболее распространенным элементом земной коры (содержание того же порядка, что и у меди ). Неодима 60 Nd более многочисленно , чем кобальт , то лютеций 71 Л (менее обильные нерадиоактивные лантаноиды), однако, более обильный , чем серебро , и туллий более обильный , чем йод .
Лантаноиды довольно хорошо подтверждают эффект Оддо-Харкинса , согласно которому элементы с атомным номером больше 4 более распространены во Вселенной, когда их атомный номер четный, чем когда он нечетный.
Элемент Атомная масса Плавление температура Температура кипения массовый объем Атомный радиус Электронная конфигурация Энергия ионизации Электроотрицательность ( Полинг ) Ионный радиус трикации Ln 3+ Лантан 138,90547 ед. 920 ° С 3464 ° С 6,162 г · см -3 187 вечера 6s 2 5d 1 (*) 538,1 кДж · моль -1 1,10 103.2 вечера Церий 140,116 (1) ед. 795 ° С 3443 ° С 6,770 г · см -3 181,8 вечера 6s 2 4f 1 5d 1 (*) 534,4 кДж · моль -1 1,12 102 вечера Празеодим 140.90766 u 935 ° С 3 130 ° С 6,77 г · см -3 182 вечера 6s 2 4f 3 527 кДж · моль -1 1.13 99 вечера Неодим 144 242 (3) u 1,024 ° С 3074 ° С 7,01 г · см -3 181 вечера 6s 2 4f 4 533,1 кДж · моль -1 1.14 98.3 вечера Прометий 1042 ° С 3000 ° С 7,26 г · см -3 183 вечера 6s 2 4f 5 540 кДж · моль -1 1.13 97 вечера Самарий 150,36 (2) ед. 1072 ° С 1900 ° С 7,52 г · см -3 180 вечера 6s 2 4f 6 544,5 кДж · моль -1 1.17 95,8 вечера Европий 151 964 (1) ед. 826 ° С 1529 ° С 5,264 г · см -3 180 вечера 6s 2 4f 7 547,1 кДж · моль -1 1.2 94.7 вечера Гадолиний 157,25 (3) ед. 1312 ° С 3000 ° С 7,90 г · см -3 180 вечера 6s 2 4f 7 5d 1 (*) 593,4 кДж · моль -1 1,20 93.8 вечера Тербий 158.92 535 ед. 1,356 ° С 3,123 ° С 8,23 г · см -3 177 вечера 6s 2 4f 9 565,8 кДж · моль -1 1.2 92.3 вечера Диспрозий 162 500 (1) ед. 1,407 ° С 2,562 ° С 8,540 г · см -3 178 вечера 6s 2 4f 10 573,0 кДж · моль -1 1,22 91.2 вечера Гольмий 164.93033 ед. 1461 ° С 2600 ° С 8,79 г · см -3 176 вечера 6s 2 4f 11 581,0 кДж · моль -1 1,23 90,1 вечера Эрбий 167 259 (3) u 1529 ° С 2868 ° С 9,066 г · см -3 176 вечера 6s 2 4f 12 589,3 кДж · моль -1 1,24 89 вечера Тулий 168.93422 ед. 1545 ° С 1,950 ° С 9,32 г · см -3 176 вечера 6s 2 4f 13 596,7 кДж · моль -1 1,25 88 вечера Иттербий 173 045 ед. 824 ° С 1,196 ° С 6,90 г · см -3 176 вечера 6s 2 4f 14 603,4 кДж · моль -1 1.1 86,8 вечера Лютеций 174.9668 ед. 1,652 ° С 3,402 ° С 9,841 г · см -3 174 вечера 6s 2 4f 14 5d 1 523,5 кДж · моль -1 1,27 86,1 вечера
- (*) Исключения из правила Клечковского : лантан 57 La, церий 58 Ce, гадолиний 64 Gd.
Распространение в природе
Оксиды актиноидов и лантаноидов часто называют циркониевой, ториевой, иттриевой землями. Они являются основным источником для получения соответствующих металлов. Уран, как главный представитель актиноидов, находится в наружном слое литосферы в форме четырёх видов руд или минералов. Прежде всего, это урановая смолка, представляющая собой двуокись урана. В ней содержание металла самое высокое. Часто диоксиду урана сопутствуют радиевые месторождения (жилы). Они встречаются в Канаде, Франции, Заире. Комплексы ториевой и урановой руды часто содержат руды других ценных металлов, например золота или серебра.

Запасами такого сырья богаты Россия, Южно-Африканская республика, Канада и Австралия. В некоторых осадочных породах содержится минерал карнотит. В его состав, кроме урана, входит еще и ванадий. Четвертый вид уранового сырья – это фосфатные руды и железоурановые сланцы. Их запасы находятся в Марокко, Швеции и США. В настоящее время перспективными считаются также залежи лигнитов и каменного угля, содержащие примеси урана. Их добывают в Испании, Чехии, а также в двух американских штатах – Северной и Южной Дакоте.
– Источник
Как электронная конфигурация f-подуровня влияет на свойства металлов (adsbygoogle = window.adsbygoogle || []).push({});
Как мы уже говорили ранее, положение лантаноидов и актиноидов в периодической системе напрямую определяет их физические и химические характеристики. Так, ионы церия, гадолиния и других элементов семейства лантаноидов имеют высокие магнитные моменты, что связано с особенностями строения f-подуровня. Это позволило использовать металлы в качестве легирующих добавок для получения полупроводников с магнитными свойствами. Сульфиды элементов семейства актиния (например, сульфид протактиния, тория) в составе своих молекул имеют смешанный тип химической связи: ионно-ковалентный или ковалентно-металлический. Эта особенность строения привела к появлению нового физико-химического свойства и послужила ответом на вопрос о том, почему лантаноиды и актиноиды обладают люминесцентными свойствами. Например, образец актиния серебристого цвета в темноте светится голубоватым свечением. Это объясняется действием на ионы металлов электрического тока, фотонов света, под влиянием которых происходит возбуждение атомов, а электроны в них «перескакивают» на более высокие энергетические уровни и затем возвращаются на свои стационарные орбиты. Именно по этой причине лантаноиды и актиноиды относятся к люминофорам.
Индивидуальные доказательства
- Вольфганг Либшер, Эккехард Флюк: Систематическая номенклатура неорганической химии . Springer-Verlag, Берлин 1999, ISBN 3-540-63097-X .
- Номенклатура неорганической химии, Рекомендации ИЮПАК 2005 .
- AM Mariano: Экономическая геология редкоземельных минералов . В: Б. Р. Липин, Г. А. Маккей (ред.): Обзоры по минералогии , том 21 — Геохимия и минералогия редкоземельных элементов (1989). Опубликовано Минералогическим обществом Америки, ISBN 0-939950-25-1 , стр. 309-337.
- Георг Штайнхаузер : Структурная химия — Прикосновение к пустоте. В кн . : Новости химии. 66, 2018, стр 118,. DOI : .
- А. Ф. Holleman , Е. Wiberg , Н. Wiberg : Учебник неорганической химии . 102-е издание. Вальтер де Грюйтер, Берлин 2007, ISBN 978-3-11-017770-1 , стр. 1937.
- ДТВ атлас по химии . 1981 , часть 1. С. 220.
- ↑
Химические свойства лантаноидов
Задача 1061.
Чем объясняется сходство химических свойств лантаноидов?Решение:
К семейству лантаноидов принадлежат четырнадцать f-элементов, следующих в периодической системе после лантана (элементы № 58 — № 71). С возрастанием порядкового номера элементов этого семейства происходит заполнение электронами подуровня третьего снаружи электронного слоя (4f-подуровня), строение же наружного, а у некоторых элементов и следующего за ним слоёв, остаются неизменными. По этой причине все лантаноиды очень близки друг к другу по химическим свойствам. Электроны заполняют 4f-, а не 5-дуровень потому, что в этом случае они обладают меньшей энергией. Однако разница в энергиях 4f- и 5d-состояний очень мала. Благодаря этому один из 4f-элементов (у некоторых, например, у церия, два 4f-электрона) легко возбуждаются, переходя на 5d-подуровень. Поэтому в большинстве своих соединений лантаноиды имеют степень окисления +3, а не +2. Это обстоятельство объясняет близость свойств лантаноидов и скандия. Лантаноиды образуют сульфиды, хлориды, оксиды – солеподобные, нерастворимые, тугоплавкие соединения. Гидроксиды М(ОН)3 – сильные основания. Катионы М3+ сильно гидратируются. С анионами одноосновных кислот и серной кислотой лантаноиды дают растворимые соли. Лантаноиды образуют многочисленные комплексные соединения. Соли их имеют различное яркое окрашивание, что возможно объяснить переходом 4f-электрона на 5d-подуровень.
Лантаноидное сжатие
Задача 1062.
Что такое лантаноидное сжатие? Как оно сказывается на свойствах d-элементов 6 периода?Решение:
С ростом атомного номера у лантаноидов наблюдается значительное уменьшение металлических и ионных радиусов (от 102 пм у церия Се до 96,1 пм у лютеция Lu). Это явление называется лантаноидным сжатием. Оно является причиной значительного роста плотности лантаноидов: от 6,19 у лантана La до 9,87 у лютеция Lu.
Основная причина лантаноидного сжатия заключается в недостаточном экранировании заряда ядра электронами 4f-орбитали.
В атомах, обладающих единственным электроном, среднее расстояние между ядром и электроном определяется электронной орбиталью, на которой находится электрон, и уменьшается с ростом заряда ядра, тем самым приводя к уменьшению величины атомного радиуса. атомах, обладающих более чем одним электроном, степень уменьшения атомного радиуса вследствие увеличения заряда ядра ослабляется вследствие увеличения электростатического отталкивания между электронами.
характеристики
Кристаллическая структура лантаноидов, кроме церия, самария, европия и иттербия.
Физические свойства
Лантаноиды — это блестящие, серебристые, относительно мягкие и химически активные металлы. Практически все они имеют наиболее плотную упаковку сфер , характерную для металлов . Твердость увеличивается с увеличением атомного номера.
Подобно актинидам , лантаноиды принадлежат к внутренним переходным элементам или элементам f-блока , поскольку f-орбитали в этих рядах не полностью заполнены электронами.
Все изотопы прометия нестабильны, то есть радиоактивны.
Химические свойства
Из-за схожей структуры валентной оболочки лантаноиды химически ведут себя как элементы 3-й группы скандия и иттрия периодической таблицы и вместе с ними образуют группу редкоземельных элементов . На воздухе они быстро окисляются и тускнеют. Они более или менее быстро реагируют с водой с образованием водорода .
Начиная с Cer, постепенно заполняется орбиталь 4f. В случае лютеция он полностью занят 14 электронами. Поскольку 4f-орбитали лежат глубоко внутри атомов , они мало влияют на химическое поведение в отличие от d-орбиталей других элементов подгруппы. Таким образом, элементы лантаноидов относительно схожи по своим химическим свойствам. Они настолько похожи, что когда в 1794 году была открыта эта земля, их даже считали оксидом одного и того же элемента. То же самое относится и к многочисленным компонентам церитовой земли. Их объединяет степень окисления +3. Кроме того, у некоторых элементов встречаются степени окисления +2 и +4.
Нарушение непрерывности ионных радиусов между гадолинием и тербием называется разрывом гадолиния в лантаноидах. Это объясняет, почему, несмотря на схожесть лантаноидов, химическое поведение элементов меняется после гадолиния. На химическое поведение можно легко повлиять на разрыв гадолиния. Следа америция достаточно, чтобы комплекс тербия приобрел структурный тип более легких лантаноидов.
Цвета ионов лантаноидов в водном растворе
| Число окисления | 57 год | 58 | 59 | 60 | 61 | 62 | 63 | 64 | 65 | 66 | 67 | 68 | 69 | 70 | 71 |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| +2 | Sm 2+ кроваво-красный | Eu 2+ бесцветный | Тм 2+ пурпурно-красный | Yb 2+ желто-зеленый | |||||||||||
| +3 | La 3+ бесцветный | Ce 3+ бесцветный | Пр 3+ желто-зеленый | Nd 3+ фиолетовый | PM 3+ фиолетовый розовый | Sm 3+ темно-желтый | Eu 3+ бесцветный | Gd 3+ бесцветный | TB 3+ бесцветный | Dy 3+ желто-зеленый | Ho 3+ желтый | He 3+ темно-розовый | TM 3+ бледно-зеленый | Yb 3+ бесцветный | Лю 3+ бесцветный |
| +4 | Ce 4+ оранжево-желтый | Пр 4+ желтый | Nd 4+ сине-фиолетовый | TB 4+ красно-коричневый | Dy 4+ оранжево-желтый |
использовать
Есть множество примеров использования лантаноидов:
Церий: основной компонент Auermetall , который используется как «кремень» в зажигалках, как оксид в самоочищающихся печах и как катализатор при крекинге .
→ Основная статья :Празеодим: находится в стекле желтого цвета, например Б. в сварочных очках.
→ Основная статья :Неодим: в основном используется для изготовления сильных магнитов. Также входит в состав сварочных стекол и используется в твердотельных лазерах вместо рубинов.
→ Основная статья :Прометий: служит источником тепла в (беспилотных) спутниках и космических аппаратах.
→ Основная статья :Самарий: используется как постоянный магнит, например Б. в наушниках.
→ Основная статья :Европий: служит поглотителем нейтронов в ядерных энергетических реакторах, а также активатором красных люминофоров в телевизионных трубках.
→ Основная статья :Гадолиний: также содержится в телевизионных трубках в качестве активатора зеленого люминофора.
→ Основная статья :Тербий: используется в качестве лазерного материала.
→ Основная статья :Диспрозий: обнаружен как поглотитель нейтронов в ядерных энергетических реакторах.
→ Основная статья :Гольмий: встречается только в сплавах. В общем, лантаноиды часто встречаются в сплавах, они облегчают обработку стали.
→ Основная статья :Эрбий: содержится в фотографических фильтрах.
→ Основная статья :Тулий: также служит поглотителем нейтронов на атомных электростанциях.
→ Основная статья :Иттербий: производит рентгеновские лучи без электричества, например Б. в портативных рентгеновских аппаратах.
→ Основная статья :Лютеций: катализатор крекинга и полимеризации.
→ Основная статья :
ХОД УРОКОВ
I. Диалог на уроке
Актуализация знаний обучающихся о строении атома и Периодическом законе Д. И. Менделеева, классификации неорганических веществ и их свойствах в свете теории электролитической диссоциации и окислительновосстановительных реакциях, о генетической связи между классами соединений.
Изучение нового материала происходит с опорой на содержание § 1 учебника.
Вопросы и задания
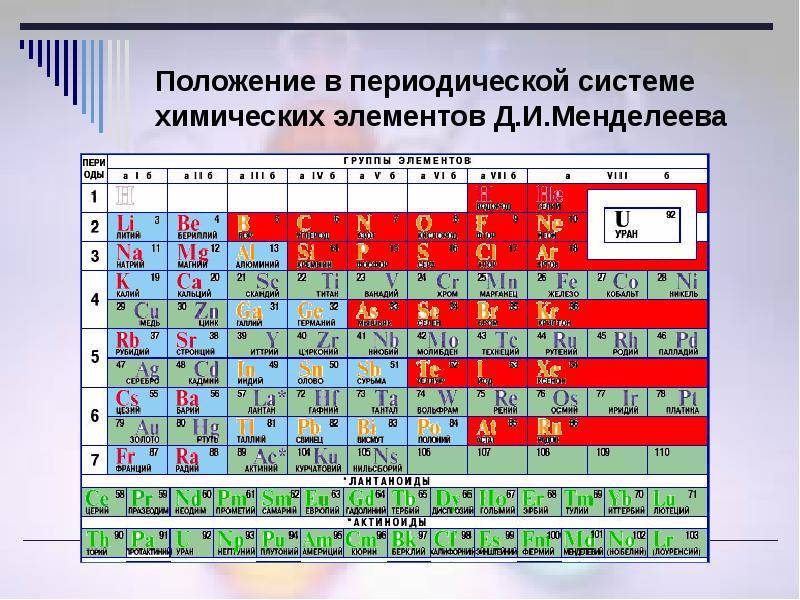
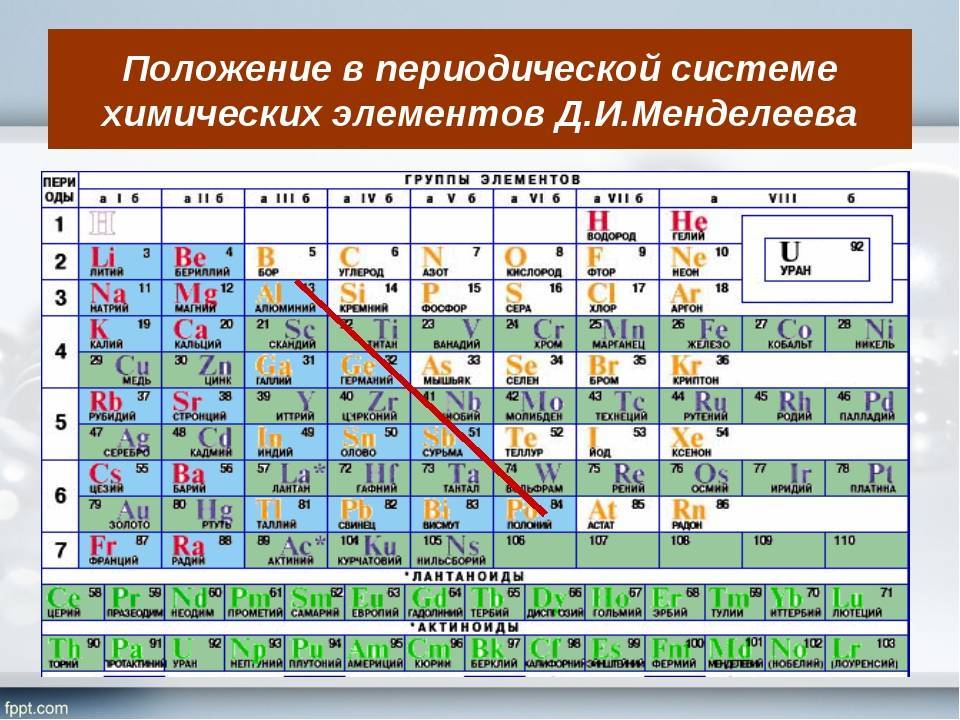
1) Вспомните, какая взаимосвязь существует между строением атома химического элемента и его положением в Периодической системе Д. И. Менделеева (заряд ядра атома, число протонов, нейтронов, общее число электронов, число заполняемых энергетических уровней, число внешних электронов у элементов главных подгрупп).
2) Как изменяются свойства атомов, простых веществ и соединений, образованных химическими элементами, в пределах главных подгрупп и периодов Периодической системы Д. И. Менделеева? Мотивируйте свой ответ.
3) Дайте характеристику химического элемента лития в соответствии с планом.
Записи в тетради
План характеристики химического элемента
- Положение в Периодической системе химических элементов Д. И. Менделеева и строение его атомов (заряд ядра атома, массовое число протонов, нейтронов, общее число электронов в нейтральном атоме, строение электронной оболочки, высшая степень окисления).
- Характер простого вещества (металл, неметалл).
- Сравнение свойств простого вещества со свойствами простых веществ, образованных соседними по подгруппе элементами.
- Сравнение свойств простого вещества со свойствами простых веществ, образованных соседними по периоду элементами.
- Состав высшего оксида, его характер (осно́вный, кислотный, амфотерный).
- Состав высшего гидроксида, его характер (основание, кислородсодержащая кислота, амфотерный гидроксид).
Состав летучего водородного соединения (для неметаллов).
4) Какой тип химической связи существует в соединении натрия с водородом? Какими физическими свойствами будет обладать это соединение?
5) Составьте генетический ряд натрия (металла).
6) Дайте характеристику химического элемента фосфора в соответствии с планом.
7) Составьте генетический ряд фосфора (неметалла).
I. Систематизация пройденного материала
Выполнение заданий № 1(б), 2, 3 после § 1 учебника с последующей само или взаимопровер кой и, в случае необходимости, коррекцией допущенных ошибок.
II. Подведение итогов
Обучающиеся устно отвечают на проблемный вопрос урока.
Домашнее задание: § 1, выполнить задания № 4—7 после § 1; № 8 на с. 17 в рабочей тетради.
Примечания и ссылки
- Иногда они написаны лантаноиды в связи с ИЮПАК по рекомендации для вызова этих элементов лантаноиды на английском языке для того , чтобы избежать путаницы с минеральными анионами , которые на английском языке имеют суффикс -ide : фторид для ионов фторида F — , хлорид для ионов хлора Cl — , галогенид для галогенида , сульфида для сульфида и т. д. В английском языке эта рекомендация мало соблюдается, во французском она тем более, тем более что в нашем языке не существует путаницы с минеральными анионами.
- (in) , раздел 1: Основные константы, единицы и коэффициенты преобразования , подраздел: Электронная конфигурация нейтральных атомов в основном состоянии , 84- е онлайн-издание, CRC Press, Бока-Ратон, Флорида, 2003.
- (in) Родерик П. Макдональд , Использование фильтра из оксида гольмия в спектрофотометрии , Clinical Chemistry , Vol. 10,
декабрь 1964, стр. 1117-1120 - (in) Альберт К. Левин и Фрэнк С. Палилла , Новый высокоэффективный катодолюминесцентный люминофор с красным светом (YVO 4
: Eu) для цветного телевидения » , Applied Physics Letters , vol. 5, п о 6,15 сентября 1964 г., стр. 118-120 - (in) Мэтью Р. Макдональд, Джефферсон Э. Бейтс, Джозеф В. Циллер, Филипп Фурче и Уильям Дж. Эванс , Завершение серии двух ионов лантаноидов для элементов: синтез молекулярных комплексов Pr 2+ , Gd2 +.
, Tb 2+ и Lu 2+ » , Журнал Американского химического общества , т. 135, п о 26,3 июля 2013 г., стр. 9857-9868