Природные соединения с содержанием меди
Чистая медь, которую собой представляют ее самородки, представлена в природе в очень незначительных количествах. В основном медь в природе присутствует в виде различных соединений, наиболее распространенными из которых являются следующие.
- Борнит – минерал, получивший свое название в честь ученого из Чехии И. Борна. Это сульфидная руда, химический состав которой характеризует ее формула – Cu5FeS4. Борнит имеет и другие названия: пестрый колчедан, медный пурпур. В природе эта руда представлена в двух полиморфных видах: низкотемпературной тетрагонально-скаленоэдрической (температура меньше 228 градусов) и высокотемпературной кубически-гексаоктаэдрической (больше 228 градусов). Данный минерал может иметь различные виды и в зависимости от своего происхождения. Так, экзогенный борнит – это вторичный ранний сульфид, который очень неустойчив и легко разрушается при выветривании. Второй тип – эндогенный борнит – характеризуется непостоянством химического состава, в котором могут присутствовать халькозин, галенит, сфалерит, пирит и халькопирит. Теоретически минералы данных видов могут включать в свой состав от 25,5% серы, более 11,2% железа и свыше 63,3% меди, но на практике такое содержание этих элементов никогда не выдерживается.
- Халькопирит – минерал, химический состав которого характеризуется формулой CuFeS2. Халькопирит, имеющий гидротермальное происхождение, раньше называли медным колчеданом. Наряду со сфалеритом и галенитом он входит в категорию полиметаллических руд. Данный минерал, который, кроме меди, содержит в своем составе железо и серу, формируется в результате протекания метаморфических процессов и может присутствовать в двух типах медных руд: контактово-метасоматического вида (скарны) и горные метасоматические (грейзены).
- Халькозин – сульфидная руда, химический состав которой характеризуется формулой Cu2S. Такая руда содержит в своем составе значительное количество меди (79,8%) и серу (20,2%). Эту руду часто называют «медным блеском», что объясняется тем, что ее поверхность выглядит как отблескивающий металл, обладающий различными оттенками – от свинцово-серого до совершенно черного. В медесодержащих рудах халькозин выглядит как плотные или мелкозернистые включения.

Халькопирит
В природе встречаются и более редкие минералы, которые содержат в своем составе медь.
- Куприт (Cu2O), относящийся к минералам оксидной группы, часто можно встретить в местах, где есть малахит и самородная медь.
- Ковеллин – сульфидная порода, сформированная метасоматическим путем. Впервые этот минерал, содержание меди в котором составляет 66,5%, был обнаружен в начале позапрошлого столетия в окрестностях Везувия. Сейчас ковеллин активно добывают на месторождениях в таких странах, как США, Сербия, Италия, Чили.
- Малахит – минерал, хорошо известный всем как поделочный камень. Наверняка все видели изделия из этого красивейшего минерала на фото или даже являются их обладателями. Малахит, который в России очень популярен, – это углекислая медная зелень или дигидрококскарбонат меди, относящийся к категории полиметаллических медесодержащих руд. Найденный малахит свидетельствует о том, что рядом есть месторождения других минералов, содержащих медь. В нашей стране крупное месторождение этого минерала находится в районе Нижнего Тагила, раньше его добывали и на Урале, но сейчас его запасы там значительно истощены и не разрабатываются.
- Азурит – минерал, который из-за своего синего цвета также называют «медной лазурью». Он характеризуется твердостью 3,5–4 единицы, основные его месторождения разрабатываются в Марокко, Намибии, Конго, Англии, Австралии, Франции и Греции. Азурит часто сращивается с малахитом и залегает в тех местах, где поблизости расположены месторождения медесодержащих руд сульфидного типа.

Малахит
Почему используют именно сплавы?
Технику производят из металлических материалов с многочисленными свойствами. Чистейшие и полученные различные способами металлы содержат в себе небольшие следы примесей, но не обладают нужными характеристиками. Чтобы добиться необходимых эксплуатационных свойств, используют сплавы. Они обладают необходимыми физическими свойствами и позволяют производить огромное количество разнообразных изделий. Сплавами называют однородные макроскопические материалы, которые являются двух- и многокомпонентными. Основная доля химических элементов приходится именно на металлы.
Сплавы отличаются собственной структурой. Все сплавы состоят из следующих компонентов:
- основы — один либо большее количество металлов;
- добавки — модифицирующие либо легирующие в небольшом количестве;
- примеси — остаточные вещества природного, случайного либо технологического характера.
Конкретный состав уже обусловлен сплавом и конкретным производимым конечным изделием.

Плавку на штейн
Плавку на штейн ведут в отражательных или электрических печах при температуре 1250 – 1300 °С. В плавку поступают обожженные концентраты медных руд, в ходе нагревания которых протекают реакции восстановления оксида меди и высших оксидов железа
6CuO + FeS = 3Cu2O + FeO + SO2
FeS + 3Fe3O4 + 5SiO2 = 5(2FeO·SiO2) + SO2
В результате взаимодействия Cu2O с FeS образуется Cu2S по реакции:
Cu2O + FeS = Cu2S + FeO
Сульфиды меди и железа, сплавляясь между собой, образуют штейн, а расплавленные силикаты железа, растворяя другие оксиды, образуют шлак. Штейн содержит 15 – 55% Cu; 15 – 50% Fe; 20 – 30% S. Шлак состоит в основном из SiO2, FeO, CaO, Al2O3.
Штейн и шлак выпускают по мере их накопления через специальные отверстия.
Общая характеристика и способы получения металлов

Значительная химическая активность металлов (взаимодействие с кислородом воздуха, другими неметаллами, водой, растворами солей, кислотами) приводит к тому, что в земной коре они встречаются главным образом в виде соединений: оксидов, сульфидов, сульфатов, хлоридов, карбонатов и т. д. В свободном виде встречаются металлы, расположенные в ряду напряжений правее водорода (Аg, Нg, Рt,Аu, Сu), хотя гораздо чаще медь и ртуть в природе можно встретить в виде соединений.
Минералы и черные породы, содержащие металлы и их соединения, из которых выделение чистых металлов технически возможно и экономически целесообразно, называют рудами.
Получение металлов из руд — задача металлургии.
Металлургия — это и наука о промышленных способах получения металлов из руд, и отрасль промышленности.
Любой металлургический процесс — это процесс восстановления ионов металла с помощью различных восстановителей. Суть его можно выразить так:
М n+ + ne−→M
Чтобы реализовать этот процесс, надо учесть активность металла, подобрать восстановитель, рассмотреть технологическую целесообразность, экономические и экологические факторы.
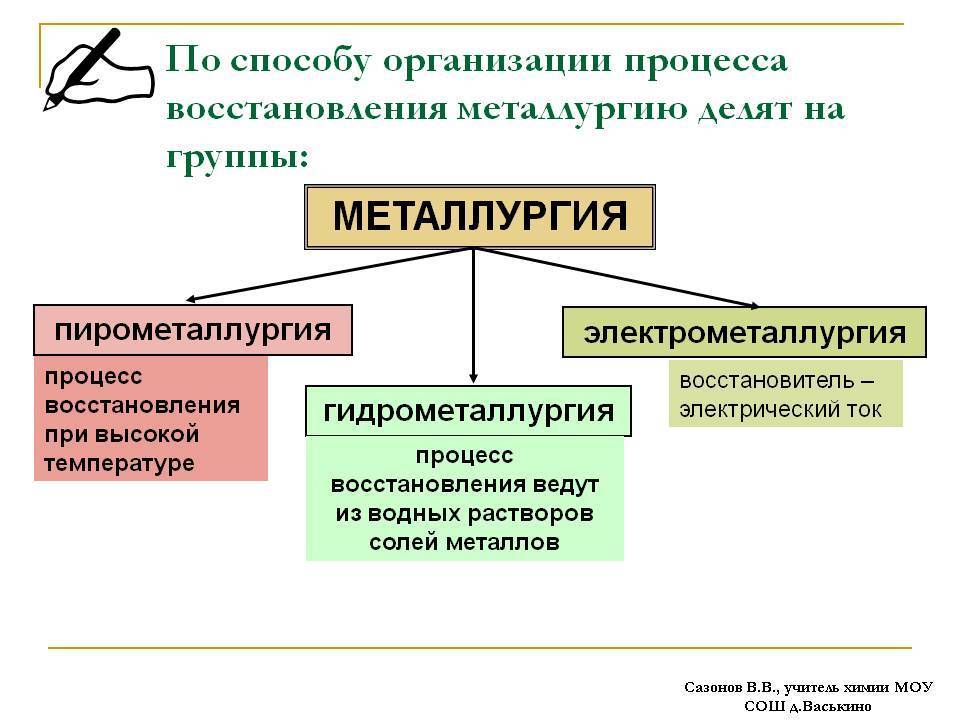
В соответствии с этим существуют следующие способы получения металлов:
• пирометаллургический;
• гидрометаллургический;
• электрометаллургический.
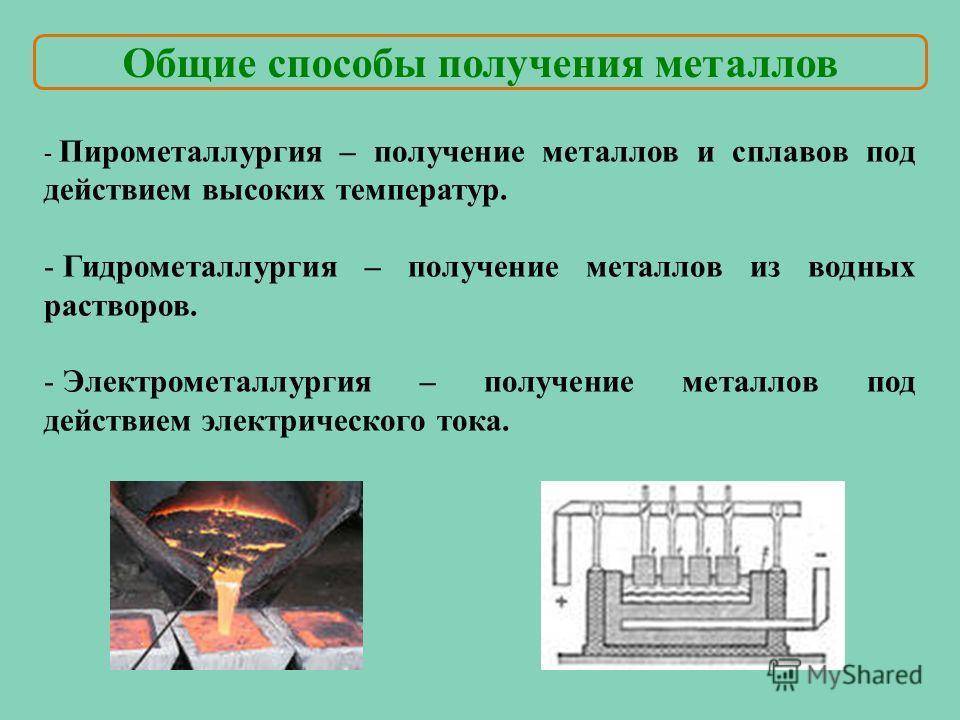
Пирометаллургия
Пирометаллургия — восстановление металлов из руд при высоких температурах с помощью углерода, оксида углерода (II), водорода, металлов — алюминия, магния.
Например, олово восстанавливают из касситерита SnО2, а медь — из куприта Cu2O
прокаливанием с углем (коксом):
Сульфидные руды предварительно подвергают обжигу при доступе воздуха, а затем полученный оксид восстанавливают углем:
Из карбонатных руд металлы выделяют также путем прокаливания с углем, т. к. карбонаты при нагревании разлагаются, превращаясь в оксиды, а последние восстанавливаются углем:
В качестве восстановителя можно применять водород или активные металлы:
1) МоO3 + ЗН2 = Мо + ЗН2O (водородотермия)
К достоинствам этого метода относится получение очень чистого металла.
2) TiO2+ 2Мg = Тi + 2МgO (магнийтермия)
ЗМnO2 + 4Аl = ЗМn + 2Аl2O3 (алюминотермия)
Чаще всего в металлотермии используют алюминий, теплота образования оксида
которого очень велика (2А1 + 1,5 O2 = Аl2O3 + 1676 кДж/моль). Электрохимический ряд напряжений металлов нельзя использовать для определения возможности протекания реакций восстановления металлов из их оксидов. Приближенно установить возможность этого процесса можно на основании расчета теплового эффекта реакции (Q), зная значения теплот образования оксидов:
Q= Σ Q1 — Σ Q 2 ,
где Q1— теплота образования продукта, Q2 -теплота образования исходного вещества.
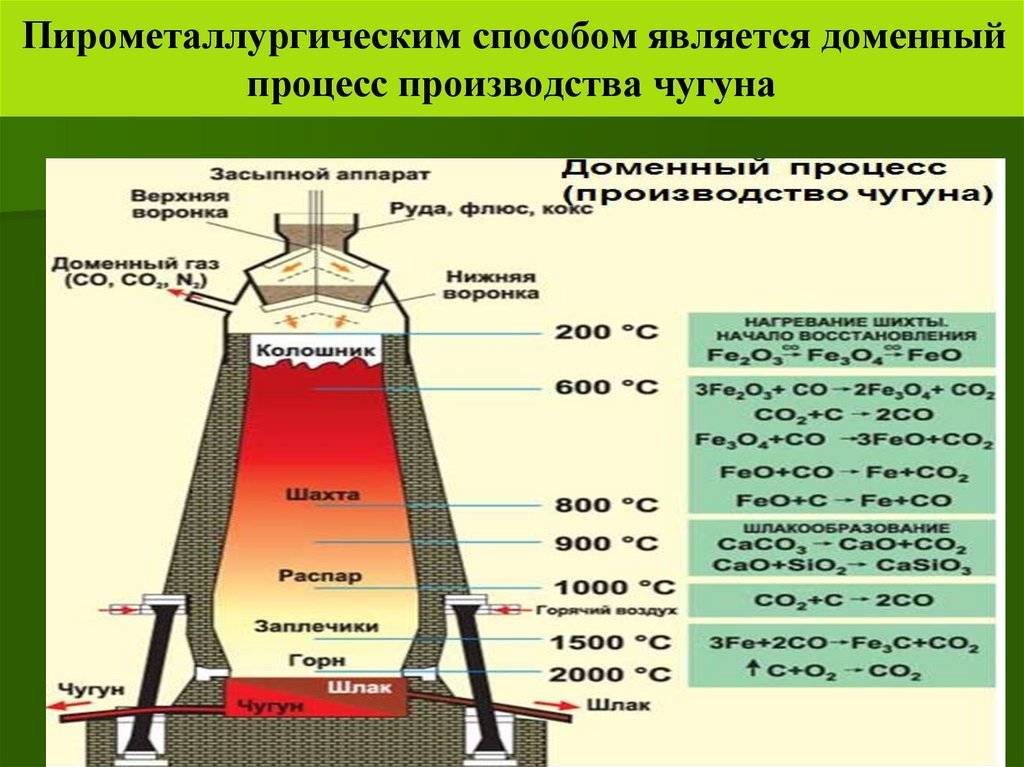
Доменный процесс (производство чугуна):C + O2 = CO2, CO2 + C 2CO3Fe2O3 + CO = 2(Fe2Fe32)O4+ CO2(Fe2Fe32)O4+ CO= 3FeO + CO2FeO + CO= Fe + CO2(чугун содержит до 6,67% углерода в виде зерен графита и цементита Fe3C);
Выплавка стали (0,2-2,06% углерода) проводится в специальных печах (конвертерных, мартеновских, электрических), отличающихся способом обогрева.
Продувание воздуха, обогащенного кислородом, приводит к выгоранию из чугуна избыточного углерода, а также серы, фосфора и кремния в виде оксидов.
При этом оксиды либо улавливаются в виде отходящих газов (CO2, SO2), либо связываются в легко отделяемый шлак – смесь Ca3(PO4)2 и CaSiO3. Для получения специальных сталей в печь вводят легирующие добавки других металлов.
Гидрометаллургия
Гидрометаллургия — это восстановление металлов из их солей в растворе.
Процесс проходит в два этапа: 1) природное соединение растворяют в подходящем реагенте для получения раствора соли этого металла; 2) из полученного раствора данный металл вытесняют более активным или восстанавливают электролизом. Например, чтобы получить медь из руды, содержащей оксид меди СuО, ее обрабатывают разбавленной серной кислотой:
СuО + Н2SО4 = СuSO4 + Н2
Затем медь либо извлекают из раствора соли электролизом, либо вытесняют из сульфата железом:
СuSO4. + Fе = Сu + FеSO4
Таким образом, получают серебро, цинк, молибден, золото, уран.
Электрометаллургия
Электрометаллургия — восстановление металлов в процессе электролиза растворов или расплавов их соединений.
Этим методом получают алюминий, щелочные металлы, щелочноземельные металлы. При этом подвергают электролизу расплавы оксидов, гидроксидов или хлоридов.
Примеры:а) NaCl (электролиз расплава) → 2Na + Cl2
Принципиальные схемы производства металлов
Металлургическим процессом называется получение металлов, сплавов, химических соединений металлов, а также металлосодержащих промежуточных продуктов.
Исходным сырьем для производства большинства металлов являются руды, для переработки которых разрабатывают технологическую схему металлургического передела, т.е. последовательность и оптимальные условия процессов, при которых достигаются наиболее высокие технико-экономические показатели по себестоимости и качеству металла.
Существуют сотни разнообразных технологических схем получения металлов, но принципиальная сущность всех схем одна – отделение металла от пустой породы и сопутствующих элементов. Весь комплекс операций, входящих в технологические схемы, целесообразно разделить на четыре стадии, в каждой из которых решается определенная задача:
- первая стадия – получение рудного концентрата механическими способами (дробление, измельчение, обогащение);
- вторая стадия – получение “химического” концентрата (обжиг, спекание-разложение, растворение, осаждение, плавка и пр.);
- третья стадия – получение “чернового” металла или его химического соединения (хлорирование, ректификация, экстракция, возгонка);
- четвертая стадия – получение чистого металла (химические и физические методы очистки).
На первой стадии процесса происходит отделение рудного минерала от пустой породы методами обогащения, в результате которых руда разделяется на две части: концентрат, куда переходит основное количество рудного минерала, и хвосты, состоящие главным образом из пустой породы.
На второй стадии схемы производят удаление оставшегося количества пустой породы химико-металлургическими методами. Итогом этой стадии является получение либо химического соединения данного металла, либо металлического сплава.
На третьей стадии в одних схемах получают «черновой металл (загрязненный примесями), в других – чистое химическое соединение металла, которое является исходным материалом для получения чистого металла на последней стадии.
На четвертой стадии получают чистый металл восстановлением соответствующего химического соединения или путем очистки «чернового» металла.
Получение металлов – задача трудная, и она существенно усложняется при переработке бедного или полиметаллического сырья. Наиболее сложные технологические схемы характерны для получения цветных металлов.
Основные процессы
Основным процессом пирометаллургии является рудная плавка, которая проводится при таких высоких температурах, когда продукты химического взаимодействия расплавляются, образуя две жидкие фазы — металлическую или сульфидную и шлаковую. Различают восстановительную и окислительную плавки.
Определяющий процесс восстановительной рудной плавки — это восстановление оксидов металла с получением в конечном итоге расплава металла или его сплава с другими элементами. Типичной восстановительной плавкой является получение чугуна в доменных печах. Восстановительные процессы являются также главными при плавке марганцевых, окисленных никелевых, свинцовых, титановых руд.
Основными реагментами-восстановителями служат углерод, оксид углерода и водород. Оксид углерода образуется в самой печи при неполном горении углерода; основное количество водорода получается в результате разложения вдуваемого в печь природного газа.
Разновидностью восстановительных плавок является металлотермическое получение металлов, при котором в качестве восстановителя какого-то металла (Mn, Cr, V и др.) используется другой металл — с большим сродством к кислороду: Ca; Mg; Al, а также Si. Одним из достоинств металлотермического восстановления является получение металлов, не загрязненных углеродом или водородом.
Типичной окислительном рудной плавкой является переработка в шахтных печах богатых медных сульфидных руд. В ходе плавки окисляется основная доля серы сульфидных минералов, в результате чего выделяется значительное количество тепла. Основным целевым продуктом плавки является расплав сульфидов FeS и Cu2S — штейн.
Чугун и штейн рудных плавок являются, по-существу, полупродуктами, которые требуют дополнительной обработки. Такая обработка заключается в продувке расплавов воздухом или чистым кислородом, в результате чего содержащиеся в сплавах примеси окисляются и переходят либо в шлак (SiO2; MnO; FeO и др.), либо в газ (СО; SO2). Процесс называется конвертированием.
Аналогичным конвертированию является фьюминг-процесс — продувка газом шлаковых расплавов. Отличие его от конвертирования состоит в том, что металлический расплав продувают окислительным газом, а при фьюминговании шлака восстановительным. А во-вторых, продукты окисления металлического расплава — оксиды металлов — образуют вторую жидкую фазу — шлак, а продукты фьюмингования шлака — восстановленные легколетучие металлы (или сульфиды) в парообразном состоянии удаляются из реакционного пространства газовым потоком.
Оборудование
Для получения и обработки применяется разное оборудование:
- Для термической обработки — печи, плавильни, горны.
- Для изменения шероховатостей поверхностей — шлифовальные станки, пескоструи.
- Для создания углублений, обработки кромок, торцов — долбежные, сверлильные, фрезеровальные станки.
- Для придания простой или сложной цилиндрической формы — токарные станки.
- Для разрезания заготовок — пилы, лазерные или гидроабразивные резаки.
Современное оборудование оснащается автоматическими системами управления, что ускоряет производство, минимизирует физические затраты со стороны человека.
Самодельный горн (Фото: Instagram / vetal7070)
Плавка
Плавка включает термические реакции, в которых по крайней мере один продукт представляет собой расплавленную фазу.
Затем оксиды металлов можно плавить путем нагревания с помощью кокса или древесного угля (формы углерода ), восстановителя, который высвобождает кислород в виде диоксида углерода, оставляя очищенный минерал. Обеспокоенность по поводу производства углекислого газа возникла недавно после выявления усиленного парникового эффекта .
Карбонатные руды также плавятся с древесным углем, но иногда их необходимо предварительно прокалить .
Возможно, потребуется добавить другие материалы в виде флюса , способствуя плавлению оксидных руд и способствуя образованию шлака , поскольку флюс вступает в реакцию с примесями, такими как соединения кремния .
Плавка обычно происходит при температуре выше точки плавления металла, но процессы значительно различаются в зависимости от используемой руды и других факторов.
Коррозия
Коррозия — процесс самопроизвольного разрушения сплавов, металлов, который происходит под воздействием окружающей среды. Ржавчина начинает появляться при воздействии кислорода, воды, оксидов серы, углерода.
Виды коррозиии:
- атмосферная.
- электролитическая;
- газовая;
- подъемная;
- биологическая.
Без металлов невозможно представить жизнь человека. Они применяются в разных сферах деятельности. Процесс добычи металлической руды для изготовления однородных материалов или сплавов практически не изменился с сотнями лет. Появилось новое оборудование, техника, но суть процесса осталась прежней.
3.4. Восстановление металлов более активными металлами
Более активные металлы вытесняют из оксидов менее активные. Активность металлов можно примерно оценить по электрохимическому ряду металлов:

Восстановление металлов из оксидов другими металлами — распространенный способ получения металлов. Часто для восстановления металлов применяют алюминий и магний. А вот щелочные металлы для этого не очень подходят – они слишком химически активны, что создает сложности при работе с ними.
Например, цезий взрывается на воздухе.
Алюмотермия – это восстановление металлов из оксидов алюминием.
Например: алюминий восстанавливает оксид меди (II) из оксида:
3CuO + 2Al = Al2O3 + 3Cu
Магниетермия – это восстановление металлов из оксидов магнием.
CuO + Mg = Cu + MgO
Железо можно вытеснить из оксида с помощью алюминия:
2Fe2O3 + 4Al → 4Fe + 2Al2O3
При алюмотермии образуется очень чистый, свободный от примесей углерода металл.
Активные металлы вытесняют менее активные из растворов их солей.
Например, при добавлении меди (Cu) в раствор соли менее активного металла – серебра (AgNO3) произойдет химическая реакция:
2AgNO3 + Cu = Cu(NO3)2 + 2Ag
Медь покроется белыми кристаллами серебра.
При добавлении железа (Fe) в раствор соли меди (CuSO4) на железном гвозде появился розовый налет металлической меди:
CuSO4 + Fe = FeSO4 + Cu
При добавлении цинка в раствор нитрата свинца (II) на цинке образуется слой металлического свинца:
Pb(NO3)2 + Zn = Pb + Zn (NO3)2
Описание
Это химические процессы, протекающие в металлургических агрегатах при высоких (800—2000°С) температурах. Поэтому пирометаллургию иногда называют «химией высоких температур». Часто химические реакции сопровождаются изменением агрегатного состояния реагирующих веществ: плавлением, возгонкой, испарением образующихся металлов или их соединений. В таких процессах взаимодействия могут протекать между твёрдой, жидкой (расплавы) и газообразной фазами в любых сочетаниях.
Пирометаллургическими процессами являются процессы агломерации металлургического сырья, плавки шихтовых материалов, изготовления сплавов, рафинирования металлов. В частности, это — обжиг, доменная плавка, мартеновская плавка, плавка в конвертерах, дуговых и индукционных печах. Пирометаллургия — основа производства чугуна, стали, свинца, меди, цинка и др.
В пирометаллургии часто применяется восстановление углеродом — в тех случаях, когда восстанавливаемые металлы не образуют устойчивых карбидов, помимо указанных выше, к таким металлам относятся германий, кадмий, олово и другие. В случаях образования восстанавливаемыми металлами устойчивых карбидов вместо восстановления углеродом часто применяется металлотермия.
Пирометаллургия — основная и наиболее древняя область металлургии. С давних времён до конца 19 столетия производство металлов базировалось почти исключительно на пирометаллургических процессах. На рубеже 19 и 20 столетий промышленное значение приобрела другая крупная ветвь металлургии — гидрометаллургия. Однако пирометаллургия продолжает сохранять господствующее положение как по масштабам производства, так и по разнообразию процессов.
В начале 20 столетия вместе с пламенными способами нагрева в металлургии начали использоваться разные виды электрического нагрева (дуговой, индукционный и др.); приблизительно в это же время в промышленности был внедрён электролиз расплавленных химических соединений (производство алюминия и других цветных металлов).
Во 2-й половине 20 столетия получили распространение плазменная плавка металлов, зонная плавка и электроогневая плавка. Металлургические процессы, основанные на использовании электрического тока, выделяют в самостоятельную область пирометаллургии — электрометаллургию.
Получение меди
После добычи руды возникает следующая проблема: как извлечь из неё необходимый материал? Существует несколько способов.
Одна из древнейших технологий заключалась в сжигании малахитовых руд с ограниченным доступом воздуха. Размещённая в горшках масса, смешанная с углём, сгорала, выделяя при этом угарный газ. Что приводило к достижению желаемого результата – получению достаточно чистой для своего времени меди.
Понятно, что за прошедшие века методы и способы переработки руд претерпевали серьёзные изменения движимые целью достижения наиболее оптимальных результатов при любом виде первичного сырья. Вот почему современная металлургия базируется на трёх основных способах получения меди.
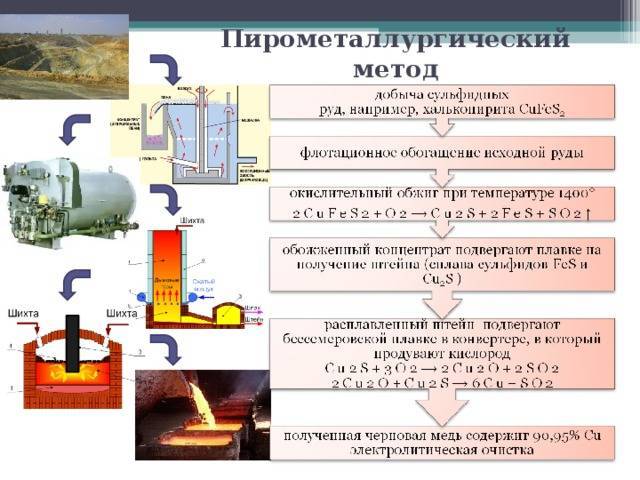
Пирометаллургический метод
Основанный на проведении высокотемпературных процессов, пирометаллургический метод как нельзя лучше подходит для сульфидных руд, подчас достаточно бедных в отношении концентрации меди. Он позволяет извлекать металл даже при содержании его в 0,5%.
Но прежде всего исходное сырьё подвергается обогащению в процессе флотации. Суть его заключается в тщательном измельчении руды, заливке её водой, добавлении туда сложных органических флотореагентов. Они обволакивают частицы минерала, содержащие в своём составе сплавы меди, придавая им несмачиваемость.
На втором этапе этого процесса в растворе создаётся пена, пузырьки которой забирают покрытые органикой частицы. Происходит это под воздействием потока воздуха, в результате чего образования всплывают на поверхность, откуда в дальнейшем забираются. Насыщенная медными соединениями пена собирается, отжимается и высушивается.
После чего полученный концентрат подвергают обжигу при температуре 14000 C. Это необходимо для удаления серы и окисления сульфидов. Затем производят высокотемпературную (14 0000 – 15 0000C) плавку в шахтных печах для получения сплава железа и меди – штейна. Далее в процессе бессемеровской плавки в конвертере под воздействием кислорода получают оксид, а затем и саму черновую медь, содержащую в себе 90,95% металла. При этом сера переходит в кислотный остаток, а железо – в силикатный шлак.
Получить из черновой субстанции чистую медь можно с помощью:
- огневого рафинирования,
- электролиза,
- экзотермической реакции восстановления под воздействием водорода.
Гидрометаллургический метод
Для извлечения меди и ряда других металлов из полиметаллических руд, содержащих в своём составе менее 0,5% искомого минерала, применяют гидрометаллургический метод.
Добытые минералы растворяют с помощью неконцентрированной серной кислоты или аммиака. Из образовавшихся жидкостей в процессе реакции вытеснения получают медь. Для проведения реакции используется металлическое железо.
Электролизный метод
Метод предназначен для получения чистой меди в процессе электролитической реакции.
Его технология заключается в изготовлении чистых медных тонких листовых катодов и толстых пластинчатых анодов из черновой меди. Помещённые затем в ванну, заполненную медным купоросом, они вступают в реакцию под воздействием электрического тока. Происходит растворение меди на анодах и её осаждение на катодах. Освободившиеся примеси удаляют химическими методами.

Медные трубы
Конвертирование штейна
Конвертирование штейна осуществляется в медеплавильных конвертерах (рисунок 44) путем продувки его воздухом для окисления сернистого железа, перевода железа в шлак и выделения черновой меди.
Конвертеры имеют длину 6 – 10 м и наружный диаметр 3 – 4 м. Заливку расплавленного штейна, слив продуктов плавки и удаление газов осуществляют через горловину, расположенную в средней части корпуса конвертера. Для продувки штейна подается сжатый воздух через фурмы, расположенные по образующей конвертера. В одной из торцевых стенок конвертера расположено отверстие, через которое проводится пневматическая загрузка кварцевого флюса, необходимого для удаления железа в шлак. Процесс продувки ведут в два периода. В первый период в конвертер заливают штейн и подают кварцевый флюс. В этом периоде протекают реакции окисления сульфидов
2FeS + 3O2 = 2Fe + 2SO2,
2Cu2S + 3O2 = 2Cu2O + 2SO2
Образующаяся закись железа взаимодействует с кварцевым флюсом и удаляется в шлак
2FeO + SiO2 = (FeO)2·SiO2
По мере накопления шлака его частично сливают и заливают в конвертер новую порцию исходного штейна, поддерживая определенный уровень штейна в конвертере. Во втором периоде закись меди взаимодействует с сульфидом меди, образуя металлическую медь
2Cu2O + Cu2S = 6Cu + SO2
Таким образом, в результате продувки получают черновую медь, содержащую 98,4 – 99,4% Cu. Полученную черновую медь разливают в плоские изложницы на ленточной разливочной машине.
Способы получения и добычи
Добыча и обработка проводится на природных рудниках. Потом расходное сырье доставляется до литейного предприятия, где происходит его переработка в конечный материал. Способы получения:
- Порошковый. При изготовлении сплавов используются порошки — смесь основных компонентов сплава по ГОСТу. С помощью специального оборудования порошок спрессовывается, ему придают определенную форму. После этого расходный материал спекают в промышленной печи.
- Литейный способ. Все компоненты будущего сплава сначала расплавляются, а потом перемешиваются. Смесь должна застыть.
Природные источники
Самое большое количество металлов содержится в земной коре. Их соединения можно найти в разных продуктах питания, воде, воздухе, химических веществах.
Природные соединения
Природные соединения:
- сульфиды — киноварь, цинковая обманка, серный колчедан;
- хлориды — каменная соль, сильвинит;
- сульфаты — гипс, глауберова соль;
- карбонаты — магнезит, доломит, известняк, мрамор, мел;
- оксиды — красный, магнитный, бурый железняк;
- нитраты — чилийская селитра.
Добыча руды (Фото: Instagram / dikomnw)
Способы добычи
Существует два способа добычи металлических руд:
- Открытый. Подразумевает разработку огромного карьера, который углубляется к центру. С его глубины на карьерных самосвалах руда вывозится наверх, где проходит дальнейшую переработку. Средняя глубина карьеров — 300 метров. Для разработки применяются крупные экскаваторы, земснаряды, карьерная техника. Карьерный метод добычи металлической руды применяется только, если после проверки почвы в ней было обнаружено более 57% руды. Главный недостаток карьера — малая глубина разработки.
- Закрытый. Подразумевает разработку шахт, которые могут уходить вниз на глубину нескольких сотен метров. Применяется, когда на поверхности после проверки было обнаружено менее 57% полезных руд. Внешне шахта напоминает колодец, который разветвляется в стороны на большой глубине. Главный недостаток — опасность для рабочих (частые обвалы, взрывы газов, большая вредность для здоровья).
Один из современных способов добычи металлической руды — СГД. Представляет собой гидромеханических метод добычи руды, который подразумевает создание глубокой шахты, снабженной трубопроводом с гидромонитором. Струя воды под большим напором подается в трубопровод. С ее помощью откалываются горные породы, которые всплывают наверх шахты. Эффективность данного способа небольшая, но он полностью безопасен для людей.
Шахта (Фото: Instagram / subcities)
Богатые рудники
Богатые железные рудники:
- Бакчарское железорудное месторождение.
- Абаканское железорудное месторождение.
- Абагасское железорудное месторождение.
- Курская магнитная аномалия.
Самые богатые месторождения алюминиевых руд находятся в
- Венгрии;
- Франции;
- Индии;
- Южной Африке;
- Казахстане;
- России;
- Югославии;
- Кольском полуострове;
- Сибири.
Богатые месторождения медной руды расположены в США, Швеции, Канаде, России, Финляндии, ЮАР.
Медная руда (Фото: Instagram / alex_tango1910)
Гидрометаллургия
Методика, которая основана на проведении химических реакциях. Они протекают в различных растворах. Наиболее распространенные материалы, которые получаются подобным способом — никель, цинк, золото.
Пирометаллургия
Из расходного сырья металл извлекается под воздействием высоких температур. Для проведения данного способа применяются печи, плавильни. Этим методом получают чугун, свинец, сталь, никель, медь, хром
Для изготовления активных металлов важно использовать восстановители
Электрометаллургия
Подразумевает обработку расходного сырья электрическим током. Сила тока изменяется зависимо от преобладающих в составе руды компонентов. С помощью электрометаллургии получаются разные металлы — щелочноземельные, щелочные. Основные из них — алюминий, магний.
- С помощью металлов. Этот процесс называют металлотермией.
- С помощью водорода. С помощью этой методики можно получить материал с наименьшим количеством посторонних вкраплений.
- С помощью углерода или оксида углерода. Эта методика называется карботермией.
Общие способы получения металлов

Значительная химическая активность металлов (взаимодействие с кислородом воздуха, другими неметаллами, водой, растворами солей, кислотами) приводит к тому, что в земной коре они встречаются главным образом в виде соединений: оксидов, сульфидов, сульфатов, хлоридов, карбонатов и т. д. В свободном виде встречаются металлы, расположенные в ряду напряжений правее водорода (Аg, Нg, Рt,Аu, Сu), хотя гораздо чаще медь и ртуть в природе можно встретить в виде соединений.
Минералы и черные породы, содержащие металлы и их соединения, из которых выделение чистых металлов технически возможно и экономически целесообразно, называют рудами.
Получение металлов из руд — задача металлургии.
Металлургия — это и наука о промышленных способах получения металлов из руд, и отрасль промышленности.
Любой металлургический процесс — это процесс восстановления ионов металла с помощью различных восстановителей. Суть его можно выразить так:
М n+ + ne−→M
Чтобы реализовать этот процесс, надо учесть активность металла, подобрать восстановитель, рассмотреть технологическую целесообразность, экономические и экологические факторы.
В соответствии с этим существуют следующие способы получения металлов:
• пирометаллургический;
• гидрометаллургический;
• электрометаллургический.
Пирометаллургия
Пирометаллургия — восстановление металлов из руд при высоких температурах с помощью углерода, оксида углерода (II), водорода, металлов — алюминия, магния.
Например, олово восстанавливают из касситерита SnО2, а медь — из куприта Cu2O
прокаливанием с углем (коксом):
Сульфидные руды предварительно подвергают обжигу при доступе воздуха, а затем полученный оксид восстанавливают углем:
Из карбонатных руд металлы выделяют также путем прокаливания с углем, т. к. карбонаты при нагревании разлагаются, превращаясь в оксиды, а последние восстанавливаются углем:
Восстановлением углем можно получить Fе, Сu, Zn, Сd, Ge, Sn, Рb и другие металлы, не образующие прочных карбидов (соединений с углеродом).
В качестве восстановителя можно применять водород или активные металлы:
1) МоO3 + ЗН2 = Мо + ЗН2O (водородотермия)
К достоинствам этого метода относится получение очень чистого металла.
2) TiO2+ 2Мg = Тi + 2МgO (магнийтермия)
ЗМnO2 + 4Аl = ЗМn + 2Аl2O3 (алюминотермия)
Чаще всего в металлотермии используют алюминий, теплота образования оксида
https://youtube.com/watch?v=_-nVROAFWAY
которого очень велика (2А1 + 1,5 O2 = Аl2O3 + 1676 кДж/моль). Электрохимический ряд напряжений металлов нельзя использовать для определения возможности протекания реакций восстановления металлов из их оксидов. Приближенно установить возможность этого процесса можно на основании расчета теплового эффекта реакции (Q), зная значения теплот образования оксидов:
Q= Σ Q1 — Σ Q 2 ,
где Q1— теплота образования продукта, Q2 -теплота образования исходного вещества.
Доменный процесс (производство чугуна):C + O2 = CO2, CO2 + C 2CO3Fe2O3 + CO = 2(Fe2Fe32)O4+ CO2(Fe2Fe32)O4+ CO= 3FeO + CO2FeO + CO= Fe + CO2(чугун содержит до 6,67% углерода в виде зерен графита и цементита Fe3C);
Выплавка стали (0,2-2,06% углерода) проводится в специальных печах (конвертерных, мартеновских, электрических), отличающихся способом обогрева.
Продувание воздуха, обогащенного кислородом, приводит к выгоранию из чугуна избыточного углерода, а также серы, фосфора и кремния в виде оксидов.
При этом оксиды либо улавливаются в виде отходящих газов (CO2, SO2), либо связываются в легко отделяемый шлак – смесь Ca3(PO4)2 и CaSiO3. Для получения специальных сталей в печь вводят легирующие добавки других металлов.
Гидрометаллургия
Гидрометаллургия — это восстановление металлов из их солей в растворе.
Процесс проходит в два этапа: 1) природное соединение растворяют в подходящем реагенте для получения раствора соли этого металла; 2) из полученного раствора данный металл вытесняют более активным или восстанавливают электролизом. Например, чтобы получить медь из руды, содержащей оксид меди СuО, ее обрабатывают разбавленной серной кислотой:
СuО + Н2SО4 = СuSO4 + Н2
Затем медь либо извлекают из раствора соли электролизом, либо вытесняют из сульфата железом:
СuSO4. + Fе = Сu + FеSO4
Таким образом, получают серебро, цинк, молибден, золото, уран.
Электрометаллургия
Электрометаллургия — восстановление металлов в процессе электролиза растворов или расплавов их соединений.
Этим методом получают алюминий, щелочные металлы, щелочноземельные металлы. При этом подвергают электролизу расплавы оксидов, гидроксидов или хлоридов.
Примеры:а) NaCl (электролиз расплава) → 2Na + Cl2