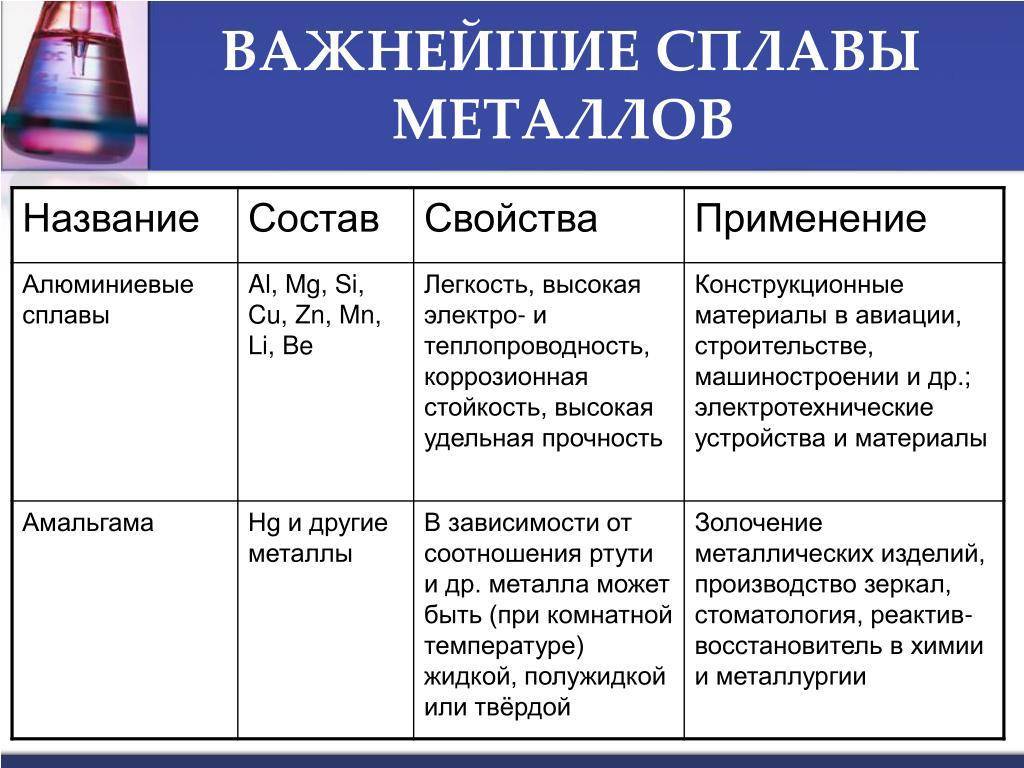
Марки и сплавы
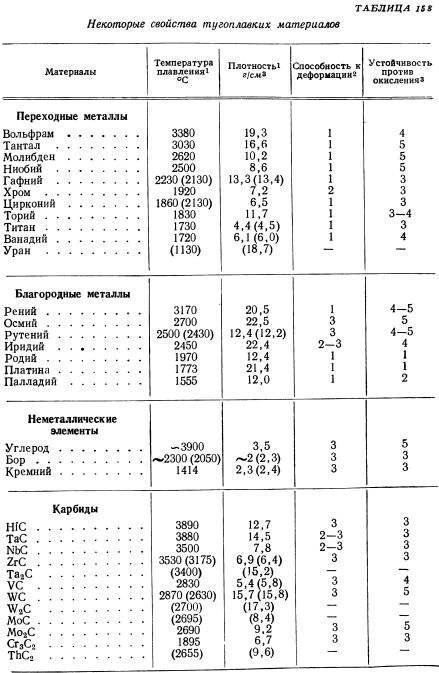
Промышленностью используется молибден как чистый металл, с присадками и сплавы.
Номенклатура марок включает десятки позиций. Самых распространенных несколько:
| Марка | Характеристики |
| МЧ | Mo – присадки отсутствуют. |
| МЧВП | Mo – присадки отсутствуют, выплавлен в вакууме. |
| МРН | Mo – присадки отсутствуют, но есть примеси. |
| МК | Mo + присадка (щелочной кремний). |
| ЦМ | Mo + присадка (циркониевая либо титановая). |
| МВ | Сплав «молибден-вольфрам». |
| МР | Сплав «молибден-рений». |
Для повышения твердости металлом снабжают кобальтово-хромовые сплавы.
У сплавов «молибден + никель + кобальт + хром» повышается сопротивляемость кислотам и термовоздействию.
Зачем вам молибден
Молибден для организма считается незаменимым микроэлементом, необходимым для выполнения многих важных жизненно важных функций.
Для чего используется молибден в организме человека
Организм использует его для расщепления макронутриентов, осуществления жизненно важных процессов, связанных с ферментами, метаболизма железа, а также предотвращения накопления вредных веществ. В частности, известно, что он действует как кофактор для четырех важных ферментов, включая сульфитоксидазу, ксантиноксидазу, альдегидоксидазу и митохондриальный восстановитель амидоксима (mARC).
Где находится молибден
В организме человека он в основном находится в печени, почках, железах и костях. Он также может быть найден в коже, мышцах, легких и селезенке.
Типы молибдена
Существует много форм этого микроэлемента, но добавки обычно содержат один из следующих типов:
- Аммоний молибдат
- Аспартат молибдена
- Цитрат молибдена
- Молибден глицинат
- Пиколинат молибдена
- Молибдат натрия
Получение молибдена
Молибден добывают из руд, содержащих до 50% непосредственно вещества, около 30% серы, 9 % кремния и незначительном присутствии других элементов. Фактически руду используют, как концентрат, подвергающийся обжигу. Температура этого этапа составляет 570 – 600 0С, он протекает в специальных печах. Результатом становится огарок, содержащий оксид молибдена, загрязненный примесями. Получить продукт обжига – МоО3 без примесей все-таки можно следующими двумя способами.

На фото молибденовая руда
Возгонка – процесс преобразования вещества из твердого состояние сразу в газообразное, минуя жидкую фазу (950 – 1100 0С);
Путем последовательных химических воздействий, начиная с аммиачной воды, что вызывает переход огарка в жидкое состояние. Оставшиеся примеси меди и железа устраняют из раствора. При этом получают полимолибдаты аммония методом выпаривания с наступлением кристаллизации вещества. Парамолибдат, прокаливают при температуре 450 – 500 0С, что дает на выходе чистый продукт МоО3. Количество примесей после такой обработки не превышает 0,05% от массы.
Чистый оксид молибдена обрабатывают в специальных трубчатых печах потоком водорода. Сначала при температуре 600 – 700 0С, повышая ее на втором этапе до 900 – 1000 0С. На выходе получают порошок, который после плавки или примененных специализированных средств порошковой металлургии преобразуется до компактного металла.

Дисульфид молибдена
В зависимости от выбранного способа получают заготовки отличающиеся формой, весом. По мере прохождения этапов преобразования форм используются: ковка, протяжка, а также прокатка металла. Для получения заготовок весом 500 кг – 2 тонны применятся дуговая или электроннолучевая плавка.
Где используется
Однако масштабы использования диктует цена: рений востребован там, где заменить его нечем. Применяются в основном сплавы.
Рений как металл востребован следующими отраслями:
Самолето-, ракетостроение. Главный потребитель металла (70%). Двигатели сверхзвуковых самолетов для оборонного и гражданского сектора. Присутствие рения в сплаве материала увеличивает грузоподъемность лайнера.
- Химия, нефтепереработка. Металл ценится как восстанавливаемый катализатор. Идет на производство элитных марок бензина.
- Ядерная медицина. Изотопами металла диагностируют, лечат сложные формы недугов, включая онкологию.
Новая сфера применения – покрытие. Процесс нанесения металла на поверхность называется ренированием. Им покрывают изнутри поверхности цистерн, контейнеров для агрессивных химикалий.
Недостатки металла, тормозящие применение, – редкость, сложность добычи, высокая цена.
Сплавы молибдена
Используется два сплава на основе данного металла: с вольфрамом (МВ) и рением (МР).
Сплавы молибдена с вольфрамом необходимы для повышения жаропрочности первого. При этом ухудшается деформируемость и повышается удельный вес. В таких сплавах содержится от 48 % вольфрама и от 49 до 51 % молибдена, остальное — примеси. МВ является тугоплавким, отличается высокой прочностью и устойчивостью к коррозии. Используется для изготовления тонкой проволоки, которая сворачивается в катушки или бухты.
Рений необходим для повышения пластичности молибдена. Сплавы МР содержат более 50 % рения и около 47 % молибдена. Они также используются для производства тонкой проволоки, которая применяется в специальном приборостроении.
Основные марки молибдена
В промышленности используется чистый молибден и с различными присадками. Среди наиболее распространенных можно выделить следующие марки:
Этапы производства:
- Концентрат подвергают окислительному обжигу при температуре 600 ⁰С. На выходе получают оксид молибдена, который содержит значительное количество примесей.
- Оксид очищают от примесей путем выгонки или выщелачивания огарка и дальнейшей нейтрализации.
- В трубчатой печи из чистого оксида получают порошковый металлический молибден. Для этого процесса применяют ток сухого водорода.
- Порошок превращают в металл. Как правило, для этого используют один из двух методов — плавка или порошковая металлургия.
Для получения ферромолибдена применяется реакция восстановления молибденитового концентрата, который предварительно подвергается обжигу.



Молибден в организме человека
Молибден относится к микроэлементам, необходимым человеку. Он содержится преимущественно в костях, почках и печени, а также в головном мозге, щитовидной и поджелудочной железах, надпочечниках.
Роль и функции молибдена для организма:
Суточная потребность в молибдене составляет от 70 до 300 мкг в зависимости от массы тела. В случае дефицита микроэлемента в организме и болезней, которые им вызваны, суточная норма увеличивается.
Физико-химические характеристики
Молибден наделен многими достоинствами:
- Упругость, практически нулевое расширение при нагреве, стойкость к жару, коррозии.
- Электропроводность выше железа.
- Механическая прочность выше только у вольфрама. Но под давлением молибден обрабатывается проще.
- Главное химическое свойство металла – устойчивость перед почти всеми щелочными растворами, агрессивными кислотами независимо от их концентрации и температуры.
| Свойства атома | |
|---|---|
| Название, символ, номер | Молибде́н / Molybdaenum (Mo), 42 |
| Атомная масса (молярная масса) | 95,96(2) а. е. м. (г/моль) |
| Электронная конфигурация | 4d5 5s1 |
| Радиус атома | 139 пм |
| Химические свойства | |
| Ковалентный радиус | 130 пм |
| Радиус иона | (+6e) 62 (+4e) 70 пм |
| Электроотрицательность | 2,16 (шкала Полинга) |
| Электродный потенциал | −0,2 |
| Степени окисления | 6, 5, 4, 3, 2 |
| Энергия ионизации (первый электрон) | 684,8 (7,10) кДж/моль (эВ) |
| Термодинамические свойства простого вещества | |
| Плотность (при н. у.) | 10,22 г/см³ |
| Температура плавления | 2623 °C |
| Температура кипения | 4885 K |
| Уд. теплота плавления | 28 кДж/моль |
| Уд. теплота испарения | ~590 кДж/моль |
| Молярная теплоёмкость | 23,93 Дж/(K·моль) |
| Молярный объём | 9,4 см³/моль |
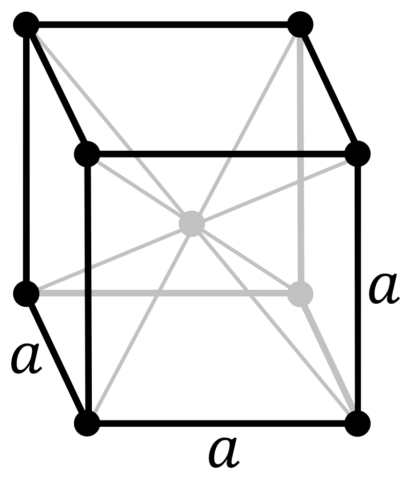
| Кристаллическая решётка простого вещества | |
| Структура решётки | кубическая объёмноцентрированая |
| Параметры решётки | 3,147 Å |
| Температура Дебая | 450 K |
Основные свойства молибдена
Металл обладает высоким удельным весом 10.2 г/см3, важным свойством молибдена является его тугоплавкость – это следствие сильных межатомных связей элемента, за счет незаполненной внутренней электронной оболочки. Результатом, присущих металлу физических свойств, выступает ряд преимуществ, которыми обладают молибден и его сплавы:
жаропрочность;
хорошая электропроводность;
низкое терморасширение;
высокая механическая прочность.
В последнем пункте металл незначительно уступает вольфраму, однако превосходит его в доступности обработки давлением. Еще одна важная специфика вещества, обеспечившая ему место в качестве легирующей добавки к другим металлам, их сплавам – высокая антикоррозионная способность.

Благодаря своим антикоррозионным свойствам молибден применяется даже в моторных маслах
Склонность к быстрому окислению, становится серьезным препятствием для использования молибдена. Также при температурах 700 0С наблюдается потеря прочности, что тоже исключает его использование в чистом виде. Для улучшения качеств этого материала используют несколько способов: легирование, защитное покрытие.
Сплавы, содержащие молибден
Качество молибденовых сплавов зависит от процентной доли добавленного вещества, способности примесей и основного металла взаимодействовать, а также обуславливается технологией процесса легирования.
Некоторых известные сплавы, например, вольфрам-молибден имеют неоднозначную оценку экспертов. Поскольку вольфрам хоть и способствует повышению жаропрочности материала, привносит существенные изменения в деформируемость металла. Подобные оказии случаются и с другими элементами, которыми пробовали легировать молибден.
Наиболее удачные попытки создания жаропрочных и хорошо деформируемых сплавов связаны с редко встречающимся и трудно добываемым рением. Существенные ограничения по доступа к веществу вынудили отказаться от такого типа легирования.
Однако сплавы, повышающие температурный порог использования молибдена, все же существуют и при этом не только сохраняют, но даже улучшают его пластичность. Это титан, ниобий, цирконий и гафний. Регулируя процентное соотношение перечисленных элементов, производят сплавы, способные работать при следующих высокотемпературных режимах:
1100 – 1800 0С. Легируют 0,1 – 1,5% указанными ранее элементами, а также 0,01 – 0,10% углерода;
1500 – 2000 0С. Добавляют до 50% массы Re и W с незначительным внедрением (до 0,1%) С, В, Al, Ni, Cu. Это позволяет избегать появления трещин в процессе легирования. Из таких сплавов изготавливают прутки, листы, проволоку.
Применение молибдена
Металл используется в разных областях:
В самолетостроении и ракетостроении.
Молибден и его сплавы применяются для обшивки сверхзвуковых самолетов и ракет, а также в производстве головных частей самолетов и ракет: они могут использоваться в качестве основного конструкционного материала или служить тепловым экраном.
В цветной металлургии.
Молибден значительно повышает прокаливаемость стали, прочность, устойчивость к коррозии и вязкость. Сплавы стали с добавлением молибдена применяют для изготовления ответственных изделий и деталей.
Использование молибдена в цветной металлургии также охватывает сплавы кобальта и хрома. Такая добавка повышает твердость, в результате чего сплав может быть использован для истирающихся кромок деталей. Молибден также входит в состав жаростойких кислотоупорных сплавов на основе хрома, никеля и кобальта.
Так как молибден имеет высокую температуру плавления, его применяют при изготовлении инструментов для горячей обработки стали. Из него также производят стержни для литья под давлением различных сплавов.
В химической промышленности.
Из молибдена делают оборудование, работающее в кислотной среде. Из него также изготавливают нагревательные элементы для печей, которые работают в атмосфере водорода.
Многие соединения молибдена служат катализаторами реакций. Некоторые из них также входят в состав глазурей и красок.
В стекольной промышленности.
Этот металл устойчив в расплавленном стекле, благодаря чему его применяют при плавке стекла и производстве электродов.
В радиоэлектронной промышленности и рентгенотехнике.
Из молибдена изготавливают детали вакуумных приборов — рентгеновских трубок, электронных ламп и др.
Большую часть изделий мы делаем из нержавеющей стали. В обязательном порядке из нержавейки изготавливается второе дно дымника — эта деталь принимает на себя горячий дым из трубы, поэтому требования к антикоррозийной защите здесь повышенные.
Иногда наши клиенты пытаются проверить качество нержавеющей стали с помощью магнита — есть такой «народный способ». Но не спешите обвинять поставщика в обмане, если вдруг обнаружили магнитные свойства у «нержавейки». На самом деле сейчас выпускается более 250 марок стали, которая имеет общее название «нержавеющая», но по составу и свойствам сильно отличается и вполне может быть магнитной.
Процессы переработки
Необходимо отметить, что отнюдь не все молибденсодержащие материалы хорошо обогащаются методами флотации. К ним относятся: окисленные руды, а также кеки, хвосты – всевозможные отходы, получаемые в процессе переработки руды и концентраторов.
Основным методом переработки в таких случаях становится:
- обжиг методом селикотермии с последующим восстановлением алютермией и углеродом;
- обжиг с выщелачиванием растворителями;
- обжиг с подшихтовкой на основе извести или окалины железа;
- обжиг с возгонкой;
- спекание с содой для последующего выщелачивания водой;
- прямое хлорирование или хлоридовозгонка;
- гидрометаллургические способы с использованием кислорода, гидрохлоридов щелочных соединений металлов, азотной кислоты (процесс осуществляется в автоклаве).
К примеру, обжиг с возгонкой представляет собой следующий двухэтапный технологический процесс:
- Первый этап включает в себя нагрев до температуры 500-6000C, продолжающийся 1-2 часа.
- Второй длится от 2 до 4 часов при температуре 1000-11000C.
При этом в печь подаётся воздух, а возгоны – улавливаются.
История и происхождение названия
Открыт в 1778 г. шведским химиком Карлом Шееле, который прокаливая молибденовую кислоту, получил оксид МоО3. В металлическом состоянии впервые получен П. Гьельмом в 1782 г. восстановлением оксида углём: он получил молибден, загрязненный углеродом и карбидом молибдена. Чистый молибден в 1817 году получил Й. Берцелиус.
Название происходит от греч. μολυβδος, означающего «свинец». Оно дано из-за внешнего сходства молибденита (MoS2), минерала из которого впервые удалось выделить оксид молибдена, со свинцовым блеском (PbS). Вплоть до XVIII в. молибденит не отличали от графита и свинцового блеска, эти минералы носили общее название «молибден».
Анализ и синтез
Новый металл и его соединения заинтересовали химиков XIX столетия. Чистый молибден при хранении совершенно не изменялся, он прекрасно противостоял действию влаги и воздуха. Но так было лишь при невысоких температурах: стоило нагреть его, и он начинал реагировать с кислородом; при температуре около 500°C он превращался в окисел целиком. Это, конечно, огорчало. Металл с хорошими физикомеханическими свойствами и к тому же тугоплавкий при сравнительно небольшом нагреве терял металлические свойства. Это обстоятельство (вместе со сложностью получения металлического молибдена) надолго отсрочило время, когда этот металл нашел первое практическое применение.
Соединения элемента № 42 стали применять намного раньше. В 1848 г. русский химик Г. В. Струве вместе со шведом Л. Сванбергом изучал свойства молибденового ангидрида и образуемой им кислоты. Они растворили MoO3 в концентрированном растворе аммиака и к полученному раствору прилили винного спирта. Выпал осадок канареечно- желтого цвета — молибдат аммония. Этой соли суждено было сыграть большую роль в аналитической химии.
Как раз в эти годы возникала наука о плодородии, как раз в это время благодаря работам Либиха и других ученых довольно бурно развивалась агрохимия. Специальные фабрики стали вырабатывать удобрения, содержащие фосфор и азот. И сразу понадобились реактивы, с помощью которых можно было бы легко и точно определять содержание этих элементов в различных веществах.
Полученный Струве и Сванбергом молибдат аммония оказался прекрасным реактивом на фосфор — реактивом, полностью осаждающим фосфор из растворов, позволяющим определить его содержание в любых продуктах — туках, металлах, рудах. Реактив оказался настолько хорош, что и сегодня им охотно пользуются в аналитических лабораториях, когда нужно определить содержание фосфора в образце.
Молибдат аммония нашел и другое применение. Оказалось, что он губительно действует на микроорганизмы, и его стали применять в качестве дезинфицирующего средства. Первоначально шелковые и хлопчатобумажные ткани пропитывали этим веществом только ради того, чтобы продлить срок их службы. Но позже открылась еще одна особенность воздействия этого вещества на ткань.
Если пропитанную молибдатом аммония ткань протянуть затем через раствор восстановителя (хлористого олова), то она и зависимости от концентрации реактивов окрашивается в небесно-голубой или синий цвет. Это вообще характерно для кислых растворов солеи молибденовой кислоты: под действием восстановителей они синеют. Такую краску называют молибденовой синью, или минеральным индиго. Было составлено много рецептов для окрашивания тканей молибденовыми солями не только в синий, но и красный, желтый, черный, бурый цвета. Окрашивали этими солями шерсть, мех, кожу, дерево и резину. Использовали молибденовые соединения и для приготовления лаков, и для окраски керамики. Например, фарфор окрашивается в голубой цвет молибдатом натрия, а в желтый — все тем же молибдатом аммония. Очень ценится оранжевая краска из молибдата и хромата свинца.
А сернистый молибден, из которого в давние времена делали карандаши, стали добавлять к глине, окрашивая керамические изделия при обжиге в желтый или красный цвет (в зависимости от количества MoS2).
Применение
Около 3⁄4 всего производимого редкоземельного металла используется как легирующий элемент при производстве сталей. Оставшаяся 1⁄4 часть используется в чистом виде и в химических соединениях. Применение он нашел во многих отраслях промышленности.
- Космическая область и авиастроение. Изделия из молибдена и его сплавов нашли применение для облицовки и изготовления головок ракет и носов самолетов, летающих на скоростях выше звуковых. Использование как конструкционный материал – это обшивка, а как тепловой экран – головная часть.
- Металлургия. Применение молибдена в литейном производстве и металлургии обусловлено высокой прокаливаемостью. Следовательно, повышается прочность, коррозионная стойкость, вязкость. В его сплавах с кобальтом или хромом заметно повышается твердость. Из легированных сталей с молибденовыми добавками изготавливаются ответственные детали. Его добавляют в жаро- и кислотоустойчивые сплавы. Поэтому большинство инструментов, производящих горячую обработку, изготавливаются из сталей, легированных Мо.
- Химическая промышленность. Из материалов с Мо, обладающих кислотоустойчивостью, изготавливают различные аппараты для производства кислот или их переработки. Нагреватели печей, внутри которых водородная среда также изготавливаются из молибденовых сплавов. Также данный металл можно найти в составе некоторых лаков, красок, эмалей и термически наносимых глазурей. Используют металл и как катализатор для химических реакций.
- Радиоэлектроника. Мо — незаменимый материал для изготовления электроосветительных и электронно-вакуумных приборов, среди которых многим известны радиолампы.
- Медицина. В медицине элемент используется при изготовлении рентгеновских аппаратов.
- Изделия из стекла. Из-за плавления при высокой температуре Мо используют при плавлении стекла.
Применение
Молибден используется для легирования сталей как компонент жаропрочных и коррозионностойких сплавов. Молибденовая проволока (лента) служит для изготовления высокотемпературных печей, вводов электрического тока в лампах накаливания. Соединения молибдена — сульфид, оксиды, молибдаты — являются катализаторами химических реакций, пигментами красителей, компонентами глазурей. Гексафторид молибдена применяется при нанесении металлического Mo на различные материалы, MoS2 используется как твёрдая высокотемпературная смазка. Mo входит в состав микроудобрений. Радиоактивные изотопы 93Mo (T
1/2 = 6,95 ч) и 99Mo (T 1/2 = 66 ч) — изотопные индикаторы.
Молибден — один из немногих легирующих элементов, способных одновременно повысить прочностные, вязкие свойства стали и коррозионную стойкость. Обычно при легировании одновременно с увеличением твёрдости растёт и хрупкость металла. Известны случаи использования молибдена при изготовлении в Японии холодного оружия в XI—XIII веках.
Молибден-99 используется для получения технеция-99, который используется в медицине при диагностике онкологических и некоторых других заболеваний. Общее мировое производство молибдена-99 составляет около 12 000 кюри в неделю (из расчёта активности на шестой день), стоимость молибдена-99 — 46 млн долларов за 1 грамм (470 долларов за 1 Ки).
В 2005 году мировые поставки молибдена (в пересчёте на чистый молибден) составили, по данным «Sojitz Alloy Division», 172,2 тыс. тонн (в 2003 году — 144,2 тыс. тонн). Чистый монокристаллический молибден используется для производства зеркал для мощных газодинамических лазеров. Теллурид молибдена является очень хорошим термоэлектрическим материалом для производства термоэлектрогенераторов (термо-ЭДС 780 мкВ/К). Трёхокись молибдена (молибденовый ангидрид) широко применяется в качестве положительного электрода в литиевых источниках тока.
Молибден применяется в высокотемпературных вакуумных печах сопротивления в качестве нагревательных элементов и теплоизоляции. Дисилицид молибдена применяется в качестве нагревателей в печах с окислительной атмосферой, работающих до 1800 °C.
Из молибдена изготовляются крючки-держатели тела накала ламп накаливания, в том числе ламп накаливания общего назначения.
Молибденовая проволока диаметром 0,05—0,2 мм используется в проволочных электроэрозионных станках для резки металлов с очень высокой точностью (до 0,01 мм), в том числе и заготовок большой толщины (до 500 мм). В отличие от медной и латунной проволоки, которые используются однократно в подобных станках, молибденовая — многоразовая (~300—500 метров хватает на 30—80 часов непрерывной работы), что несколько уменьшает точность обработки, но повышает её скорость и снижает её стоимость.
Свойства молибдена (таблица): температура, плотность, давление и пр.:
Подробные сведения на сайте ChemicalStudy.ru
| 100 | Общие сведения | |
| 101 | Название | Молибден |
| 102 | Прежнее название | |
| 103 | Латинское название | Molybdaenum |
| 104 | Английское название | Molybdenum |
| 105 | Символ | Mo |
| 106 | Атомный номер (номер в таблице) | 42 |
| 107 | Тип | Металл |
| 108 | Группа | Переходный, тяжёлый металл |
| 109 | Открыт | Карл Вильгельм Шееле, Швеция, 1778 г. |
| 110 | Год открытия | 1778 г. |
| 111 | Внешний вид и пр. | Блестящий металл серебристо-белого цвета |
| 112 | Происхождение | Природный материал |
| 113 | Модификации | |
| 114 | Аллотропные модификации | |
| 115 | Температура и иные условия перехода аллотропных модификаций друг в друга | |
| 116 | Конденсат Бозе-Эйнштейна | |
| 117 | Двумерные материалы | |
| 118 | Содержание в атмосфере и воздухе (по массе) | 0 % |
| 119 | Содержание в земной коре (по массе) | 0,00011 % |
| 120 | Содержание в морях и океанах (по массе) | 1,0·10-6 % |
| 121 | Содержание во Вселенной и космосе (по массе) | 5,0·10-7 % |
| 122 | Содержание в Солнце (по массе) | 9,0·10-7 % |
| 123 | Содержание в метеоритах (по массе) | 0,00012 % |
| 124 | Содержание в организме человека (по массе) | 0,00001 % |
| 200 | Свойства атома | |
| 201 | Атомная масса (молярная масса) | 95,96(2) а. е. м. (г/моль) |
| 202 | Электронная конфигурация | 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d5 5s1 |
| 203 | Электронная оболочка | K2 L8 M18 N13 O1 P0 Q0 R0
|
| 204 | Радиус атома (вычисленный) | 190 пм |
| 205 | Эмпирический радиус атома* | 154 пм |
| 206 | Ковалентный радиус* | 154 пм |
| 207 | Радиус иона (кристаллический) | Mo3+ 83 (6) пм, Mo4+ 79 (6) пм Mo5+ 75 (6) пм, Mo6+ 73 (6) пм (в скобках указано координационное число – характеристика, которая определяет число ближайших частиц (ионов или атомов) в молекуле или кристалле) |
| 208 | Радиус Ван-дер-Ваальса | |
| 209 | Электроны, Протоны, Нейтроны | 42 электрона, 42 протона, 54 нейтрона |
| 210 | Семейство (блок) | элемент d-семейства |
| 211 | Период в периодической таблице | 5 |
| 212 | Группа в периодической таблице | 6-ая группа (по старой классификации – побочная подгруппа 6-ой группы) |
| 213 | Эмиссионный спектр излучения | |
| 300 | Химические свойства | |
| 301 | Степени окисления | -4, -2, -1, 0, +1,+2, +3, +4, +5, +6 |
| 302 | Валентность | II, III, IV, V, VI |
| 303 | Электроотрицательность | 2,16 (шкала Полинга) |
| 304 | Энергия ионизации (первый электрон) | 684,32 кДж/моль (7,09243(4) эВ) |
| 305 | Электродный потенциал | Mo3+ + 3e– → Mo, Eo = -0,2 В |
| 306 | Энергия сродства атома к электрону | 71,9 кДж/моль |
| 400 | Физические свойства | |
| 401 | Плотность* | 10,28 г/см3 (при 20 °C и иных стандартных условиях, состояние вещества – твердое тело), 9,33 г/см3 (при температуре плавления 2623 °C и иных стандартных условиях, состояние вещества – жидкость) |
| 402 | Температура плавления* | 2623 °C (2896 K, 4753 °F) |
| 403 | Температура кипения* | 4639 °C (4912 K, 8382 °F) |
| 404 | Температура сублимации | |
| 405 | Температура разложения | |
| 406 | Температура самовоспламенения смеси газа с воздухом | |
| 407 | Удельная теплота плавления (энтальпия плавления ΔHпл)* | 37,48 кДж/моль |
| 408 | Удельная теплота испарения (энтальпия кипения ΔHкип)* | 598 кДж/моль |
| 409 | Удельная теплоемкость при постоянном давлении | 0,251 Дж/г·K (при 25 °C), 0,272 Дж/г·K (при 0-100 °C) |
| 410 | Молярная теплоёмкость* | 24,06 Дж/(K·моль) |
| 411 | Молярный объём | 9,4 см³/моль |
| 412 | Теплопроводность | 138 Вт/(м·К) (при стандартных условиях), 138 Вт/(м·К) (при 300 K) |
| 500 | Кристаллическая решётка | |
| 511 | Кристаллическая решётка #1 | |
| 512 | Структура решётки | Кубическая объёмно-центрированная
|
| 513 | Параметры решётки | 3,147 Å |
| 514 | Отношение c/a | |
| 515 | Температура Дебая | 450 K |
| 516 | Название пространственной группы симметрии | Im_ 3m |
| 517 | Номер пространственной группы симметрии | 229 |
| 900 | Дополнительные сведения | |
| 901 | Номер CAS | 7439-98-7 |
Примечание:
205* Эмпирический радиус атома молибдена согласно и составляет 139 пм.
206* Ковалентный радиус молибдена согласно и составляет 154±5 пм и 130 пм соответственно.
401* Плотность молибдена согласно и составляет 10,22 г/см3 (при 0 °C/20 °C и иных стандартных условиях, состояние вещества – твердое тело).
402* Температура плавления молибдена согласно составляет 2620 °С (2893,15 K, 4748 °F).
403* Температура кипения молибдена согласно и составляет 4611,85 °С (4885 K, 8333,33 °F) и 4630 °С (4903,15 K, 8366 °F) соответственно.
407* Удельная теплота плавления (энтальпия плавления ΔHпл) молибдена согласно и составляет 28 кДж/моль и 36,4 кДж/моль соответственно.
408* Удельная теплота испарения (энтальпия кипения ΔHкип) молибдена согласно составляет 582,4 кДж/моль.
410* Молярная теплоёмкость молибдена согласно составляет 23,93 Дж/(K·моль).
Молибден в организме человека

Молибден относится к микроэлементам, необходимым человеку. Он содержится преимущественно в костях, почках и печени, а также в головном мозге, щитовидной и поджелудочной железах, надпочечниках.
Роль и функции молибдена для организма:
- Участвует в углеводном, белковом и липидном обмене, в процессах очищения от мочевой кислоты, альдегидов и прочих вредных веществ.
- Снижает интоксикацию после употребления алкоголя.
- Укрепляет кости и зубы.
- Улучшает половую функцию.
- Препятствует возникновению подагры и анемии.
- Участвует в тканевом дыхании и синтезе витамина С.
Суточная потребность в молибдене составляет от 70 до 300 мкг в зависимости от массы тела. В случае дефицита микроэлемента в организме и болезней, которые им вызваны, суточная норма увеличивается.