Покрытие сплавом олово-никель.
Вопросы осаждения сплавов олово-висмут и олово-свинец рассматривались ранее (См. «Осаждение сплава олово-висмут.», «Осаждение сплава олово-свинец.» ). Назначение этих покрытий – придание поверхности специальных свойств для проведения пайки. Сплав олово-никель с содержанием никеля 35 – 40%, кроме хорошей паяемости придает изделиям высокие коррозионные свойства, так как обладает химическеской стойкостью в условиях повышенной влажности и в среде, содержащей сернистые соединения.
Покрытие олово-никель хорошо полируется, имеет высокую твердость и износостойкость, поэтому его можно использовать взамен трехслойного покрытия медь-никель-хром. При этом достаточно нанести толщину покрытия олово-никель всего 15 мкм. В зависимости от материала основы и условий эксплуатации, может потребоваться подслой меди от 5 до 30 мкм, так как покрытие олово-никель достаточно пористое. Цвет сплава – бледно-желтоватый.
Покрытие контактов сплавом олово-никель
Значения нормальных потенциалов олова и никеля отличаются незначительно – всего на 0,1 В, поэтому их сближение возможно достигнуть в простых солях. Для осаждения сплава олово-никель (35) применяют различные по составу электролиты: фторхлоридные, пирофосфатные, сернокислые.
Наибольшее распространение получили фторхлоридные электролиты, основными компонентами которых являются хлориды олова и никеля с добавлением фторидов натрия и аммония. Фторид аммония уменьшает окисление олова из двухвалентного в четырехвалентное и увеличивает рассеивающую способность электролита, придает осадкам блеск и хрупкость.Фторид натрия придает осадкам пластичность. Однако одновременное введение этих солей позволяет получить пластичные и блестящие покрытия.
Состав электролита:
Олово хлористое 45 – 50 г/л
Никель хлористый 250 – 300 г/л
Аммоний фтористый 70 – 100 г/л
(или натрий фтористый)
Температура 50 – 60С
ДК = 1 – 1,5 А/дм2
рН = 3,5 – 4,5
Аноды из сплава олово-никель с содержанием никеля 30% или никелевые и оловянные раздельные в соотношении поверхностей 1:5.
При снижении концентрации олова или никеля в электролите уменьшается его содержание в сплаве. При увеличении плотности тока осадки становятся матовыми.
Получаемый сплав олово-никель – однофазное интерметаллическое соединение, имеет достаточно большое переходное сопротивление и является преградой для диффузии золота, поэтому сплав олово-никель наносят еще и в качестве подслоя под покрытие драгметаллами.
Подслой под золото – сплав олово-никель
Похожие публикации:
- «Анализ причин нестабильности адгезии покрытия ХимНМОВи к поверхности деталей из алюминиевых сплавов.»
- «Химическое осаждение никеля – за и против!»
Удаление дефектных гальванических покрытий.
Необходимость удаления гальванических покрытий возникает при нарушении качества покрытия (См. «Неполадки в гальванике») в силу каких-либо обстоятельств. Главной причиной процесса удаления покрытия является желание восстановить первоначальное состояние детали, изготовление которой связано с высокими трудозатратами или высокой стоимостью материала, из которого она сделана.
Процесс удаления покрытия должен быть максимально щадящим и направлен на удаление покрытия без каких-либо последствий для подложки, поэтому в травильные растворы добавляют ингибиторы.
Процесс удаления гальванических покрытий может быть химическим (без воздействия тока) и электрохимическим (когда деталь является анодом). Химический процесс, как правило, протекает более медленно, но равномерно, а электрохимический – анодный более быстро, но требует постоянного контроля.
Наилучшие результаты по снятию покрытия достигаются электрохимически – при анодной обработке в комплексных цианистых электролитах, а при химическом травлении – в растворах с органическими катализаторами. Однако, из-за высокой токсичности и агрессивности эти растворы не нашли широкого применения в производстве. Чаще технологи останавливают свой выбор на простых щелочных растворах или смесях кислот.
Наиболее популярными являются растворы для снятия покрытий:
1) хромового покрытия с поверхности меди, никеля и стали – 10–30 % раствор соляной кислоты при температуре 30–40С;
2) никелевого покрытия со стали – концентрированная азотная кислота;
3) медного покрытия со стали – 500 г/л хромового ангидрида с 50 г/л серной кислоты при температуре 20С;
4) кадмиевого покрытия со стали – концентрированная соляная кислота, в качестве ингибитора можно добавить 15 г/л хлористой сурьмы;
5) свинцового покрытия с меди – концентрированная азотная кислота с 300 г/л фторида аммония и 125 г/л пероксида водорода при температуре 20С.
Составы электролитов для анодного стравливания гальванических покрытий:
1) хромового покрытия с никеля – 50 г/л углекислого натрия при ДА = 5 – 10 А/дм2;
2) сплава олово – висмут с меди и со стали – стандартный электролит эл/химического обезжиривания при ДА = 5 – 10 А/дм2 и температуре 40С;
3) никелевого покрытия со стали – 60% раствор серной кислоты (в объемном соотношении) с 30 г/л глицерина, ДА = 10 – 15 А/дм2, температура 20С;
4) медного с цинка – 220 г/л хромового ангидрида с 2 г/л серной кислоты, ДА = 10 А/дм2, температура 20С.
К сожалению, не всегда возможно удалить гальваническое покрытие без повреждения основы. Например, изделия из цинковых сплавов с покрытием медь-никель-хром не поддаются реставрации, часто повторное использование восстановленного изделия экономически становится невыгодно, так как качество самой детали ухудшаются.
Тем не менее, если что-то очень эксклюзивное необходимо спасти – пробуйте, экспериментируйте, за услугами обращайтесь к нам, всегда поможем.

Цех гальванических покрытий
- «Причины нарушения качества гальванических покрытий.»
- «Анализ причин нестабильности адгезии покрытия ХимНМОВи к поверхности деталей из алюминиевых сплавов.»
Примеры меднения своими руками
Сначала необходимо удалить никелировку. Для этого деталь удерживается пинцетом, на который подается «минус» от блока питания. Тряпочкой, закрепленной на
плюсовом электроде, смоченной в 5% серной кислоте, протирается поверхность изделия.
При снятии никелировки образуются ядовитые пары, от которых необходимо защищать органы дыхания. Желательно использовать специальные очки и респиратор с угольным фильтром. Очищенная поверхность полируется.
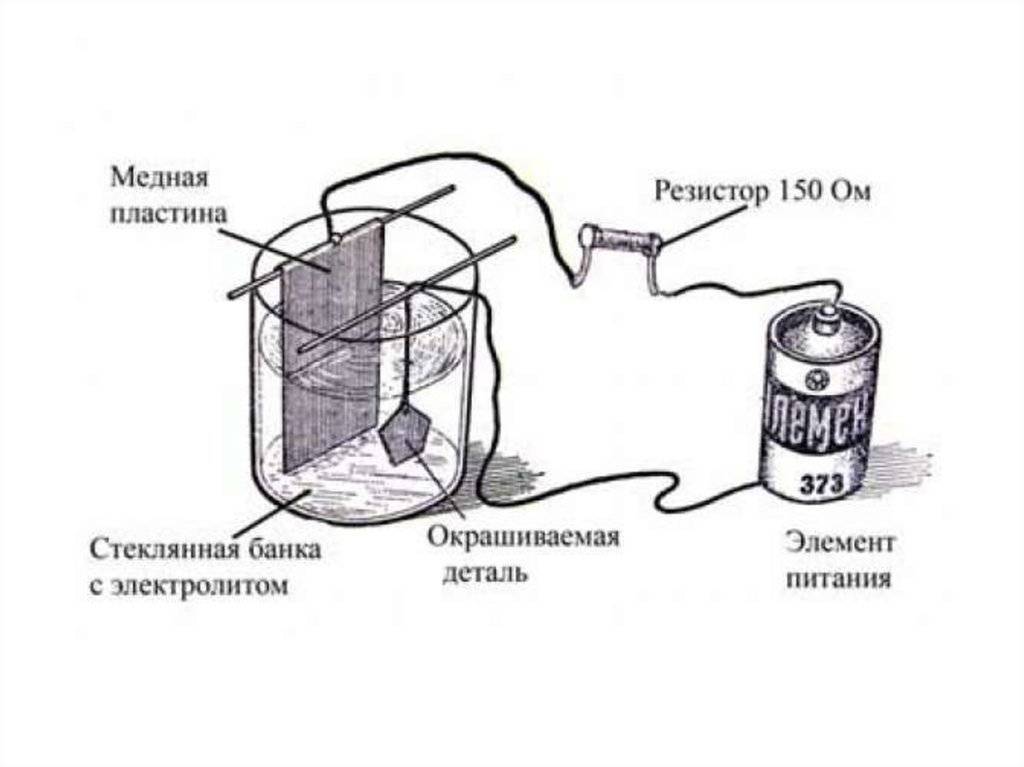
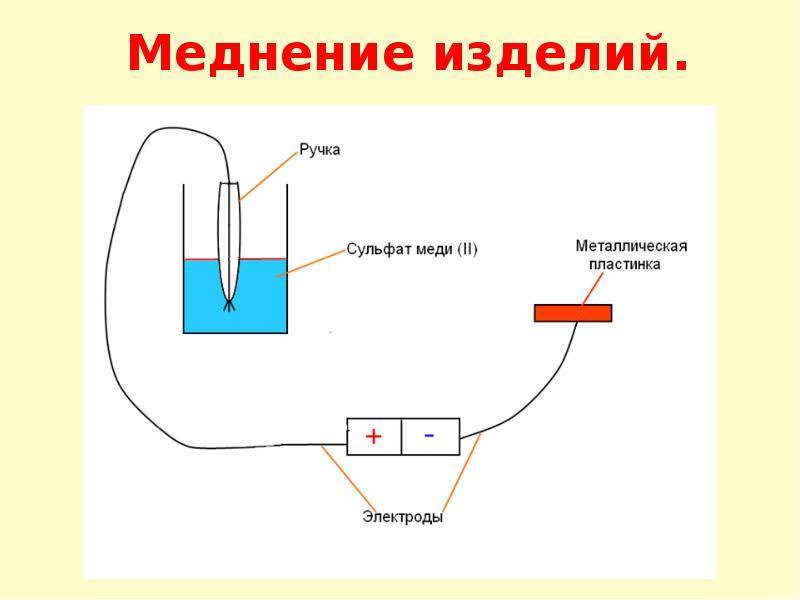
Следующий шаг – сборка простейшей гальванической установки. В банку помещается медный электрод, соединяемый с «плюсом» БП, и обрабатываемая деталь, подключаемая к «минусу».
Заливается электролит, состоящий из медного купороса, воды и 5% серной кислоты в пропорции 1/5/3 и подается ток. Готовые изделия полируются до приятного блеска.
Для домашнего меднения существует множество различных применений. Наносить медь можно на алюминиевые столовые приборы, давая им вторую жизнь, на рыболовные блесны, подсвечники и многое другое. Особенно впечатляют работы, в которых декоративное покрытие нанесено на неметаллические предметы: стебли растений, листья, желуди и даже на высушенных насекомых. Природная фактура исходного материала, сочетаясь с красотой гальванического покрытия, создает неповторимый художественный эффект.

Лак наносится тонким слоем на сухое растение, высыхает, и через час все готово для меднения. После гальванической обработки можно дополнительно улучшить внешний вид изделия. Существует несколько способов придания гальванической меди различных цветовых оттенков, в том числе с помощью патинирования, химического окрашивания и оксидирования.
Качество художественных работ, полученных по этим технологиям, находится на уровне настоящих ювелирных украшений.
Предлагаем ознакомиться: Краска для кирпичных печей термостойкая – Виды краски для кирпичей, печей и каминов (термостойкая, огнеупорная)
Различные типы меднения
Меднение в домашних условиях могут выполнять даже новички в этом направлении. Чтобы получить качественное покрытие необходимо изучить все нюансы процедуры. Она может проводиться по одной из 2 технологий:
- Погружение в электролит. Заготовка погружается в жидкость и подается электроток. Обычно, используется в тех ситуациях, когда ее габариты не значительны.
- Без погружения в раствор. Более сложный процесс, но позволяющий достигать лучшего качества обмедненных поверхностей.
Во всех случаях необходимо подведение электричества, которое активизирует вещество.
Оптимальный метод выбирается в соответствии с поставленной целью:
- Формирование защитных и декоративных покрытий. Зачастую происходит смешение с никелем, хромом и медью. Получаются прочные и надежные поверхности.
- Защита при цементировании.
- Реставрация изделий.
Рассмотрим подробнее каждый из вариантов.
Омеднение с помещением в электролит
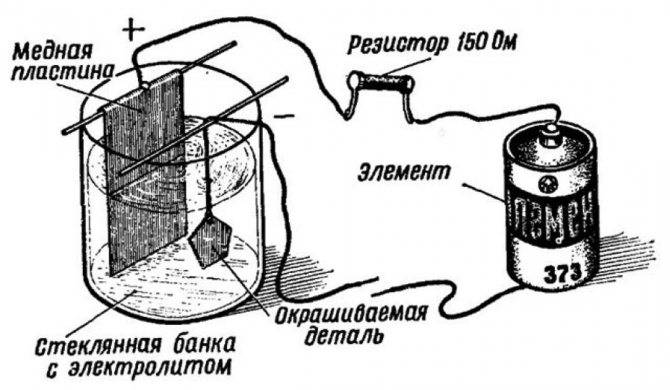
Наиболее доступный способ обмеднения в быту. Необходимы:
- Небольшого размера пластинки из меди.
- Проволока для проведения тока.
- Источник тока.
- Устройство для регулирования и измерения тока.
Последовательность действий:
- Чтобы растворить медь используется обыкновенный электролит, свободно продающийся или легко готовящийся своими руками. Для приготовления следует делать смесь серной кислоты с дистиллированной водой в пропорциях 3 к 100 миллилитрам. Нужная смесь получается после добавления в него 20 г медного купороса.
- Деталь следует очистить щеткой и наждачкой, чтобы удалить оксидную пленку.
- Провести обезжиривание раствором соды и промыть.
- Подготовленная емкость заполняется электролитическим раствором.
- В емкости размещаются 2 пластинки, подключенные к токопроводящей проволоке. Меж ними помещается деталь, которой предполагается омеднение. Нужно проверить полное закрытие смесью и пластинок, и заготовки.
- Затем пластины подключаются к плюсовому полюсу источника, а заготовка садится на минус. Предварительно желательно подключать амперметр и реостат. Выставить диапазон тока до 15 мА на 1см2 площади поверхности изделия.
- Выдержать в течение 20 минут.
- Выключается питание, заготовка извлекается из раствора. В итоге получается тонкое покрытие из меди. Продолжительность процесса оказывает влияние на толщину напыления. Благодаря технологии можно добиваться слоя до 300 мкм и более.
Метод возможно применять для обновления алюминиевых вещей, используемых в быту. Например, столовая утварь из алюминия после омеднения обретет вторую молодость.
Омеднение без помещения в раствор
Метод не предполагает залитие детали жидкостью. Он прекрасно подходит обработки цинковых или алюминиевых изделий.
Последовательность действий:
- Необходим провод – многожильный, медный. Снять изоляцию. Одна сторона распушается, делая подобие кисточки. Можно сделать что-то вроде рукояти для большего комфорта в работе. Другой край провода подключается к положительному полюсу источника тока. Напряжение – не больше 6 Вольт.
- Вышеописанным методом подготавливается электролит с медным купоросом. Посуда может использоваться любого типа, но лучше подобрать ту, которая позволит беспроблемно погружать кисточку из провода. Обрабатываемая деталь очищается от загрязнений. После этого проводами садится на отрицательный полюс источника тока.
- Процедура проводится следующим образом. Распушенный край-кисточка время от времени помещается в раствор. Ей следует проводить вдоль заготовки, не прикасаясь к ней. Поверхность нужно смочить электролитическим раствором. Во время обработки за счет отрицательного заряда деталь будет подтягивать ионы меди, покрываясь ими.
Это меднение металла подойдет для габаритных вещей, которые затруднительно поместить в емкость.
Общие сведения
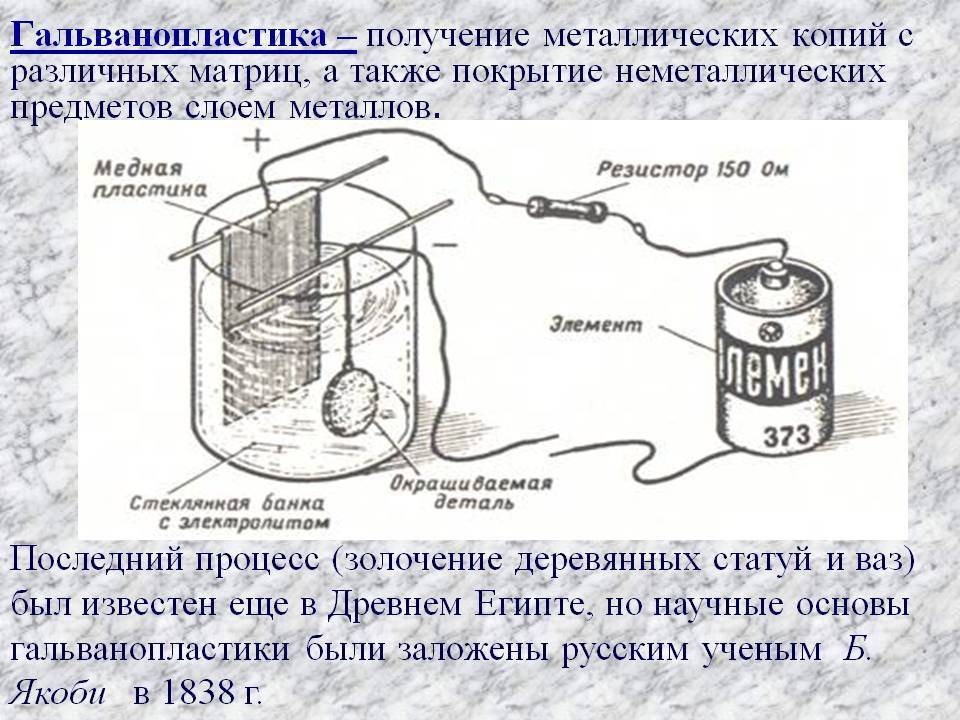
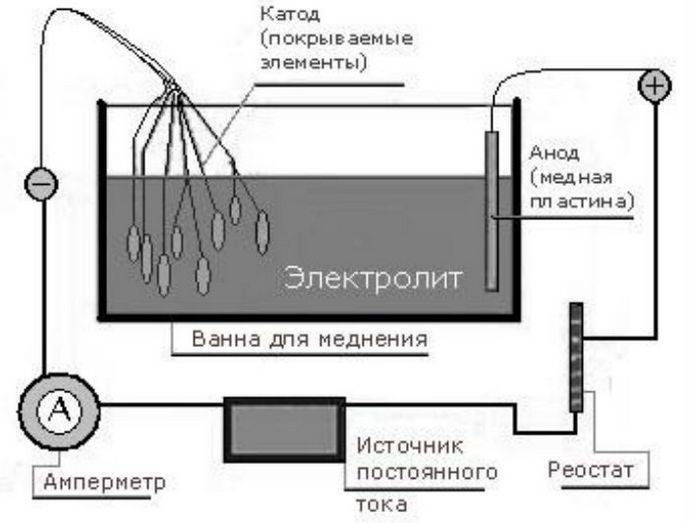
Покрытие гальваникой бывает технологическим или декоративно-защитным. Это тонкий металлический тонкий слой, который в зависимости от гальванических элементов может выполнять эстетические функции. Гальванопластика не увеличивает прочность изделия, поскольку в этом случае требуются большие производственные мощности, но для красоты и придания «свежести» вполне подойдет.
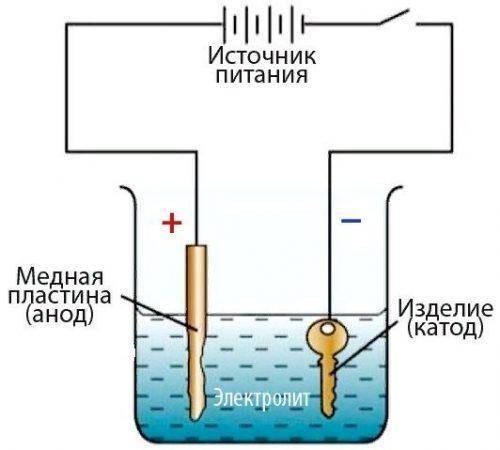
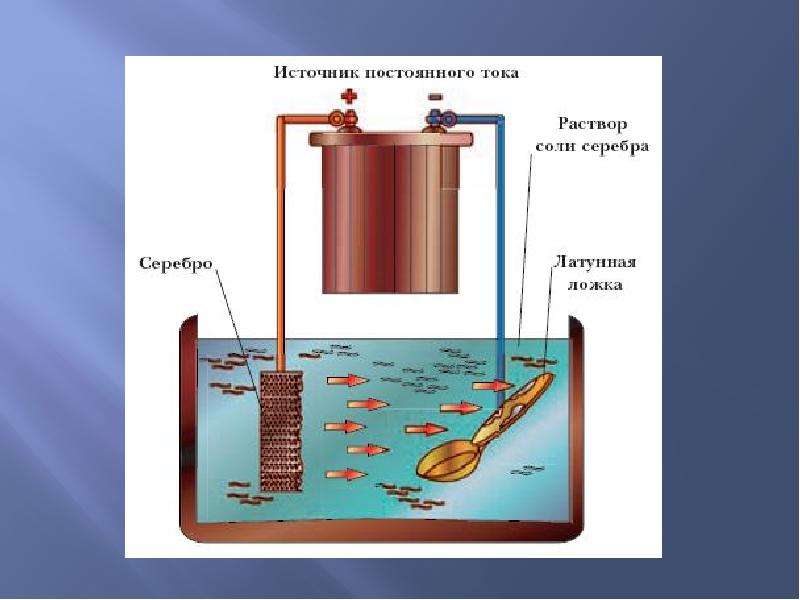
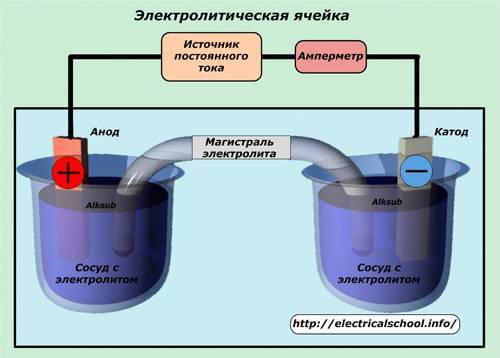
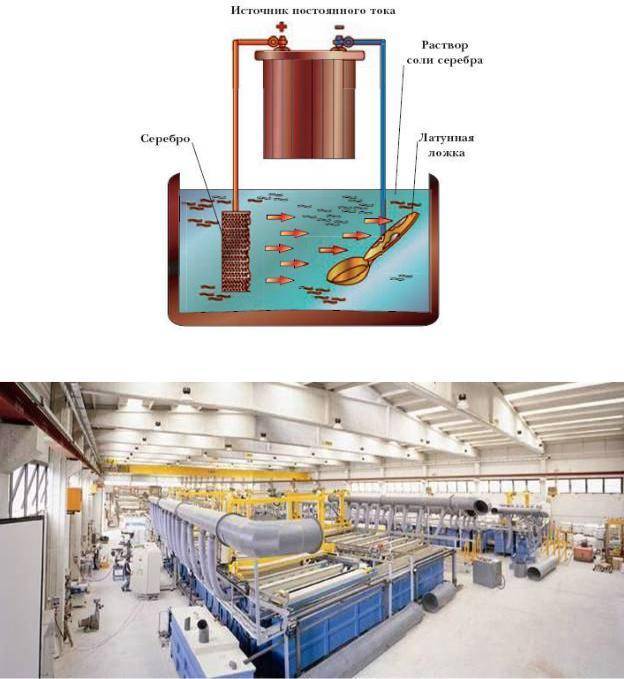
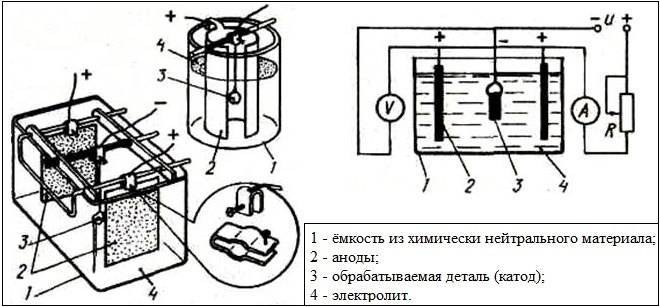
Гальванические реакции происходят с помощью постоянного электрического тока. В специальную емкость-диэлектрик наливают раствор — электролит, в который погружают два анода. Аноды должны быть изготовлены из металла, который будет осаждаться на покрываемом изделии.
Обрабатываемая деталь присоединяется к минусовому выводу и помещается между анодами. Она выполняет роль катода. Аноды, в свою очередь, присоединяются к плюсовому контакту источника питания. Они становятся частью цепи, проводя ток в электролит и отдавая ему свои металлические элементы. Электролит передает необходимые частицы обрабатываемой детали, они постепенно обволакивают её тонким слоем. Аноды по площади должны превышать в несколько раз размер заготовки.
Другими словами, гальванизация представляет собой перенос молекул металла раствора на изделие в момент протекания через них электротока.
Любой гальванический процесс можно разбить на общие этапы:
- Сборка гальванической установки.
- Подготовка электролитного раствора.
- Обработка и подготовка образца.
- Запуск гальванического процесса.
Технология гальванопластики
Технология создания точной копии предмета или художественного изделия методом гальванопластики состоит из нескольких этапов:
- Изготовление слепка рельефного предмета из воска или другого пластичного материала. При этом необходимо учитывать тот фактор, что поверхность копируемого изделия должна обладать свойством проводить электрический ток. Если же модель изготовлена из непроводящих материалов, то на нее различными способами наносят любое электропроводное покрытие. Зачастую выполняется втирание измельченной гранитной пыли в восковой подслой или применяется метод химического восстановления металлов на поверхности оригинала.
- Помещение слепка в электролит — готовую модель помещают в специальную емкость с раствором электролита.
- Проведение процедуры электролиза, в процессе которой во время пропускания тока через расплавленный металлический раствор на поверхности слепка наращивается достаточно толстый слой металла, который равномерно заполняет все неровности слепка.
- Отделение слепка от слоя металла после окончания процесса электролиза. Копию отделяют от оригинала по заранее нанесенному барьерному слою или путем химического растворения ( расплавления) оригинала.
Хромирование в домашних условиях
Подробно про хромирование дома мы расскажем в отдельной статье. Главное, что нужно понимать: Хромирование – чрезвычайно вредный процесс, особенно гальваническое хромирование. Избыток хрома в организме вызывает рак, заболевание печени и легких и много других проблем. Подробнее о вреде хрома для организма читайте здесь.
Настоятельно не рекомендуем этим заниматься самостоятельно.
Тем не менее, если вы решились – просим соблюдать технику безопасности.
1) Перчатки. В растворе для гальванического хромирования содержится шестивалентный хром. Это канцероген. Мало того, при попадании раствора на кожу, этот хром проникает в организм сквозь нее. Мытье рук не поможет! Для остальных видов хромирования перчатки не менее важны.
2) Респиратор или маска. При любом хромировании мелкие частички хрома в виде взвеси находятся в воздухе, которым мы дышим. Защитите свои легкие.
3) Очки. Не нам Вам рассказывать, что будет с глазом при попадании в него жидкого металла или куска детали.
4) Одежда, защищающая от термических ожогов, так как Вы работаете с высокими температурами
5) Обувь, желательно резиновые сапоги.
Потенциал электрода. Перенапряжение (поляризация).
Металлические электроды, опущенные в раствор электролита, содержащего одноименные с металлом ионы, обладают характеристикой, называемой равновесным потенциалом.
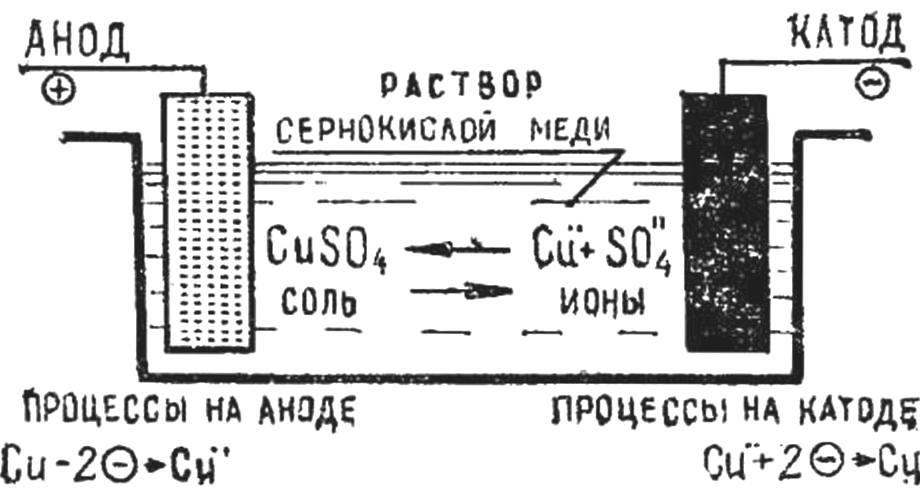
В гальванике равновновесный потенциал электрода характеризует динамическое равновесие между ионами металла, выходящими из кристаллической решетки электрода в раствор и одноименными ионами в растворе, стремящимися войти в кристаллическую решетку электрода. Скорость обмена характеризуется так называемым током обмена i0. Такая система реализуется в любом электролите для нанесения покрытий с использованием растворимых металлических анодов, например, когда мы загружаем медные аноды в электролит сернокислого меднения, состоящий из сульфата меди и серной кислоты.
При использовании нерастворимых анодов или при опускании анода в раствор, в котором отсутствую одноименные ему ионы, на нем будет реализовываться стационарный потенциал.
Равновесный потенциал привязан к величине стандартных потенциалов металлов (табличные значения) уравнением Нернста:
E = E+RT/nF*lnaOx/aRed
где:Е — Равновесный электродный потенциал, В;Е — стандартный электродный потенциал, В;R — Универсальная газовая постоянная, 8,31 Дж/(моль*К);Т — абсолютная температура, К;n- число электронов, участвующих в процессе;F — постоянная Фарадея, равная 96500 Кл*моль-1;aOx и aRed — активности соответственно окисленной и восстановленной форм вещества, участвующего в полуреакциях. Если подставить в уравнение значения R и F, перейти к десятичным логарифмам и принять, что температура 298 К, то уравнение Нернста можно преобразовать в следующий вид:
E = E+0,0592/n*lgaOx/aRed
Когда мы приложим к электродам установки разность потенциалов (проще говоря подключим источник постоянного тока) потенциал электрода будет смещаться от равновесного значения. В гальванике принято считать, что смещение катодного потенциала идет в отрицательную область, а анодного — в положительную, хотя это и условно (можно принять и обратное отношение знаков).
Смещение электродных потенциалов от равновесного значения под действием приложенного извне напряжения называется поляризацией, разница между равновесным потенциалом и потенциалом под током — перенапряжением. Поляризация и перенапряжение, по сути, синонимы. Степень зависимости плотности тока от потенциала называется поляризуемость.
Перенапряжение обозначается как ηК и ηА соответственно для обозначения катодного и анодного процесса.Наглядно эти вопросы будут разъяснены при рассмотрении поляризационных кривых.
Отметим, что чем выше перенапряжение выделения металла на катоде, тем более мелкокристаллическим будет покрытие. При осаждении покрытий стремятся получать как можно более мелкокристаллические осадки. Обоснование этого будет дано далее.
Следует также запомнить общее правило: на катоде идут преимущественно электроположительные процессы, на аноде — электроотрицательные.
Состав растворов для химического меднения.
Для осуществления процесса химического меднения рекомендуется много разнообразных растворов. В целом состав раствора химического меднения обычно включает в себя:
- соль двухвалентной меди (сульфат меди);
- комплексообразователь;
- восстановитель;
- ускоряющие и стабилизирующие добавки;
- гидроксид натрия для регулирования рН.
Виды растворов меднения различают по тому, какой используется комплексообразователь: виннокислый (тартратный), трилонатный (этилендиаминтетрауксусный), лимоннокислый, глицериновый и т.д.
Наибольшее распространение получил виннокислый раствор химического меднения. Он содержит тартрат калия-натрия, который образует с ионами меди прочный комплексный анион [CuC4H4O6(OH)2]2-. Значительное распространение получили также трилонатные растворы, содержащие комплексообразователь трилон Б (ЭДТА). Остальные растворы применяются ограниченно.
Кроме формалина в качестве восстановителей в процессе химического меднения могут использоваться гипофосфит, гидразин, боргидрид, однако растворы меднения на их основе уступают растворам с формалином по выраженности автокаталитических свойств у осаждаемой меди, а также по стабильности, и, поэтому, не нашли практического применения.
Стабилизаторами в растворе могут выступать различные тиосоединения: тиосульфат натрия, тиомочевина, сульфид свинца, цистин, роданин, 2-меркаптобензотриазол, диэтилдитиокарбамат, а также цианистые соединения, роданиды, фенантролины и их производные, полисульфиды, соединения селена, ртути, некоторые окислители (в т.ч. кислород), высокомолекулярные вещества. На виннокислые растворы химического меднения стабилизирующее действие оказывают аммиак и углекислый натрий.
Характеристики омедненных металлов
Медь имеет хорошее сцепление практически со всеми металлами и сплавами, но защитные свойства медного гальванического покрытия без дополнительных слоев невысоки. Под воздействием атмосферных факторов оно достаточно быстро разрушается, и даже в домашних условиях его обычно покрывают лаком. В то же время подслой из меди значительно улучшает характеристики многослойных покрытий в части механической прочности и коррозионной стойкости. Нержавеющие стали обычно защищают от коррозии трехслойным покрытием из хрома, никеля и меди. При этом меднение проводится первым, чтобы при использовании изделия в условиях переменных нагрузок обеспечить пластичность всего составного слоя. Точно такую же роль меднение играет в покрытиях металлопроката и листового железа, из которых изготавливают профильные изделия, эксплуатируемые в условиях морского климата и агрессивных сред. Омедненные провода и контакты из алюминия легко паяются и имеют более низкое сопротивление, особенно на высоких частотах. Технические условия электролиза позволяют при меднении металлов в декоративных целях окрашивать поверхностные слои меди в различные цвета и придавать им дополнительный блеск (на фото ниже – меднение по нержавейке).
Выбор защитного покрытия.
При разработке новых изделий перед конструктором встает нелегкая задача: в составе сборочного узла, присутствуют, как правило, несколько металлов, которым необходимо придать различные функциональные свойства – устойчивость к истиранию, перепадам температур, паяемость, повышенную электропроводимость и т.д. Кроме того, необходимо, чтобы изделие имело защитное покрытие от коррозии.
Все эти вопросы решаются путем нанесения гальванических защитных покрытий (см. «Что может гальваника?»). Но выбор защитного покрытия осложняется тем, что коррозионные процессы, которые могут происходить, зависят от условий и сред, в которых они протекают.
Детали с защитно-декоративным покрытием.
В результате коррозии происходит самопроизвольное разрушение металлов в результате взаимодействия с окружающей средой. Причиной служит термодинамическая неустойчивость конструкционных материалов.
Коррозионные процессы отличаются разнообразием условий, в которых они протекают. По типу агрессивных сред выделяют:
- газовую коррозию, т.е. химическую, происходящую под воздействием горячих газов;
- электрохимическую коррозию в различных природных средах (в загрязненном воздухе при повышенной влажности, особенно в присутствии агрессивных газов);
- морскую коррозию (под действием морской воды);
- подземную коррозию – в грунтах и почвах.
Следовательно, для выбора оптимального защитного покрытия необходимо изучить технические условия эксплуатации изделия, определить категории в части воздействия климатических факторов внешней среды.
Деталь с защитным покрытием.
В ГОСТ 15150-69 «Машины, приборы и другие технические изделия. Исполнения для различных климатических районов» приводятся типы климатов и критерии их разграничения.
Например, изделия могут эксплуатироваться в районах с умеренным, с влажным и тропическим климатом, умеренно-холодным морским климатом и т.д.
Виды климатического исполнения имеют обозначения: У4; ХЛ4; ТВ5; ТМ4.1 и т.д. Для каждой категории изделий прописываются значения рабочих и предельных температур воздуха, относительной и абсолютной влажности, нормы на содержание пыли и коррозионно-активных агентов.
При выборе комплектующих желательно подбирать материалы, которые стойкие к воздействию различных агрессивных сред. Кроме того, учитывать рекомендации ГОСТ 9.005-72 «Допустимые и недопустимые контакты металлов», в котором устанавливаются общие требования к допустимости контактов разнородных в электрохимическом отношении металлов и металлических покрытий в изделиях и к методам защиты от контактной коррозии.
После проработки вышеуказанных материалов защитное покрытие выбирается в соответствии с ГОСТ 9.303-84 «Покрытия металлические и неметаллические неорганические. Общие требования к выбору и обозначения».
На данном этапе конструктору понадобится консультация технолога: возможно ли осуществить задуманное в условиях данного производства?
Например: для деталей из углеродистой стали в условиях тропического морского климата ТМ 6 в качестве защитного покрытия конструктор выбирает кадмиевое толщиной 30 мкм (Кд30). Но, далеко не каждое производство имеет электролит кадмирования (см. «Процесс кадмирования»), так как покрытие кадмием является одним из наиболее токсичных. Кроме того, детали со сложной поверхностью и низкой степенью наводораживания возможно осуществить только из цианистого электролита.
Технолог может предложить в качестве материала использовать коррозионностойкую сталь, тогда защитным покрытием для данных условий будет 12 мкм гальванического никеля (Н12) (см. «Никелирование»).
При выборе защитного покрытия не последнюю роль играет экономический фактор и возможность механической обработки, поэтому вопрос выбора защитного покрытия необходимо решать конструктору совместно с технологом.
Как сделать домашнюю ванну для гальваники своими руками
В домашних условиях обычно проводятся более простые работы, включающие в себя нанесение на поверхность меди или никеля, поэтому гальваническая ванна с легкостью собирается даже из подручных средств
Но и в этом случае важно соблюдать ряд условий:
- емкость для ванны должна быть жесткой, устойчивой к химическим реагентам, не пропускающей через себя электричество;
- в помещении для гальваники в домашних условиях должна находиться вытяжка;
- требуется постоянный доступ к чистой воде (даже самый легкий процесс потребует как минимум 5 промывок);
Самый популярный вариант, используемый многими мастерами в домашних условиях — сделать ванну из пластиковой канистры. Для этого нужно будет срезать крышку с горловиной, а ее боковины усилить армирующим материалом. На стенки полученной установки по линии среза надеваются уплотнители (для окон или автомобилей). Далее нужно будет закрепить крышку. Финальным этапом будет проделка отверстий для контактных штанг.
Сами штанги можно изготовить в домашних условиях из медной шины, диаметр каждой –до 10 мм. В концах с обеих сторон просверливают отверстия, чтобы можно было подключать полюса от источника питания. На расположенные по краям готовой гальванической ванны штанги навешиваются анодные пластины, подключенные к электричеству. На центральную штангу надета катодная деталь, подключенная к отрицательному полюсу. Ток и напряжение определяются, исходя из объема ванны и планируемых к проведению работ.