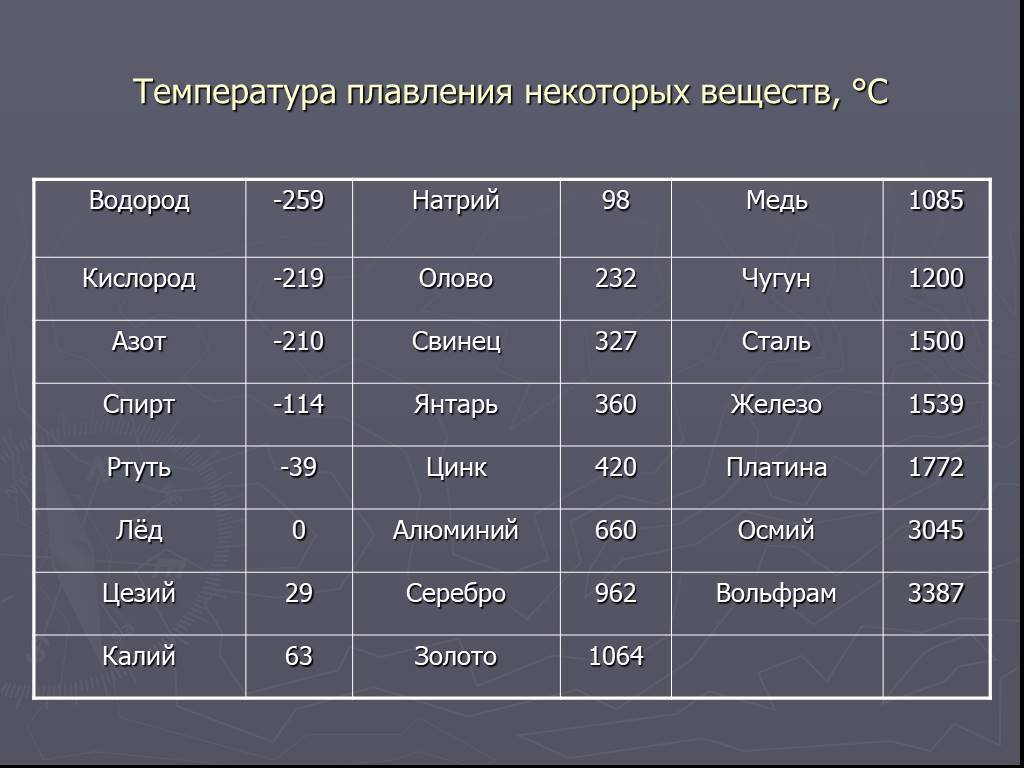
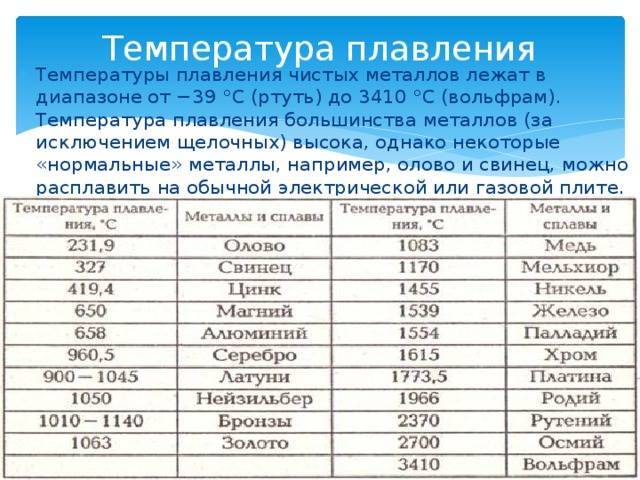
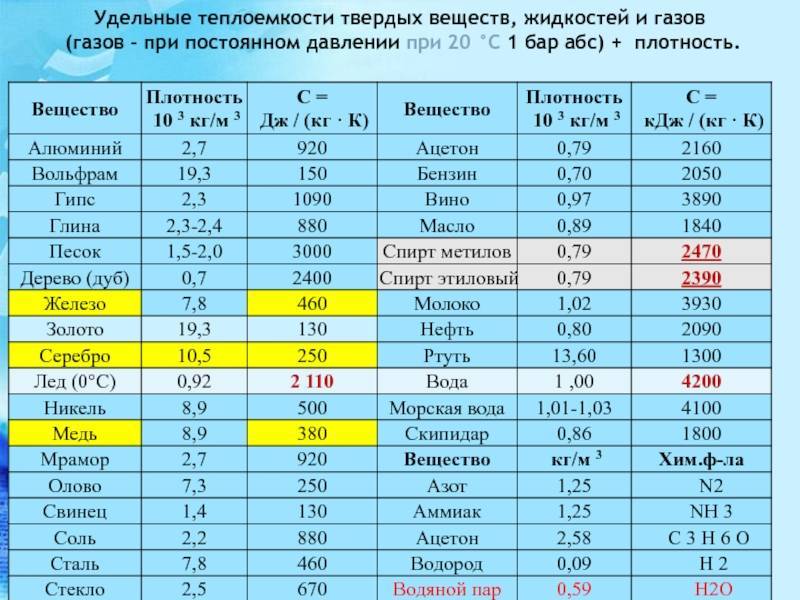
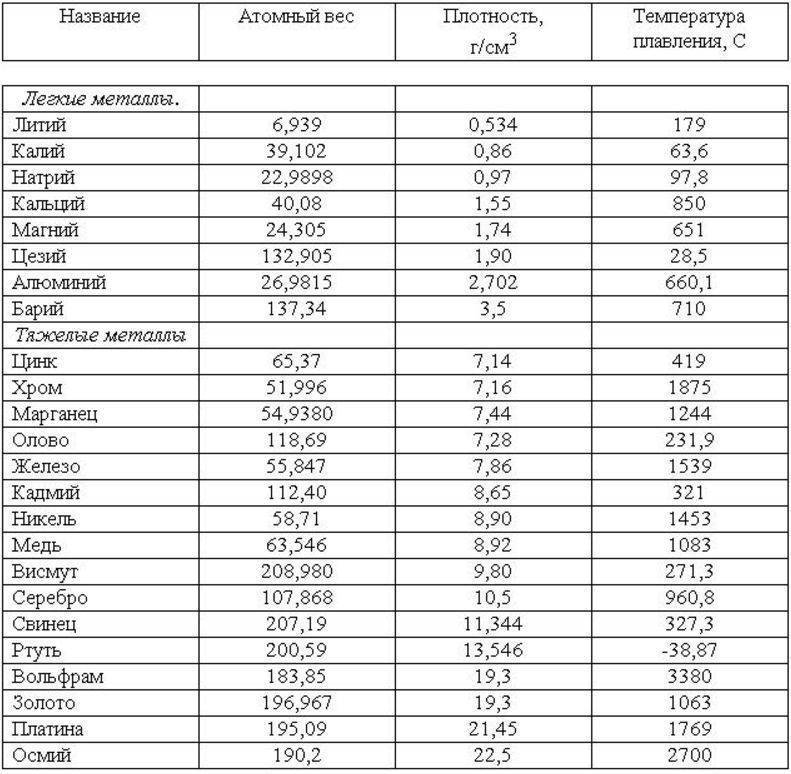
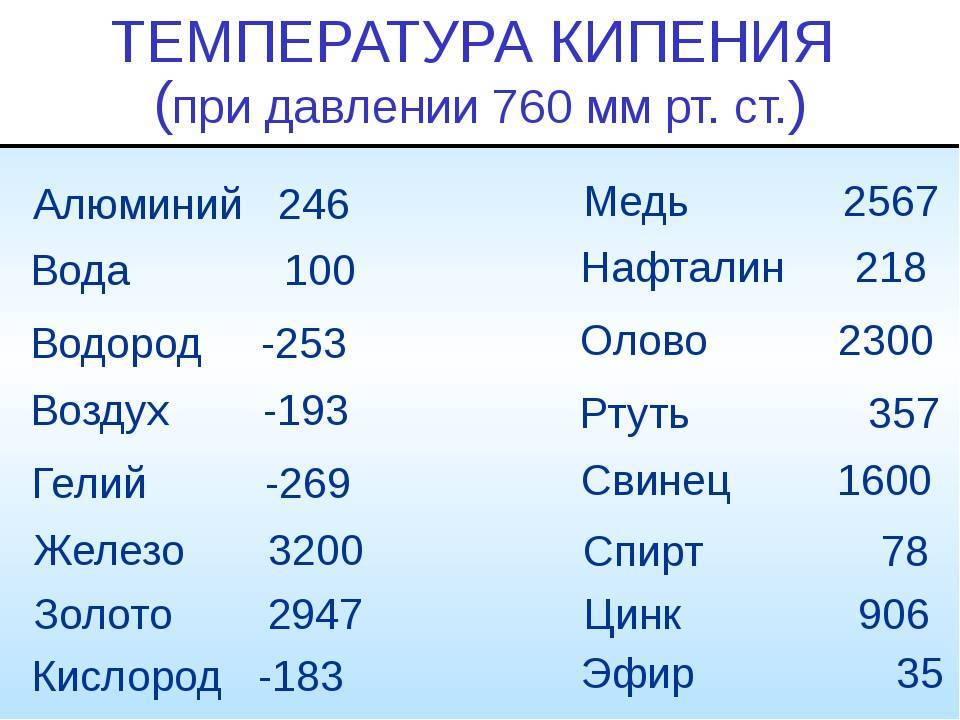
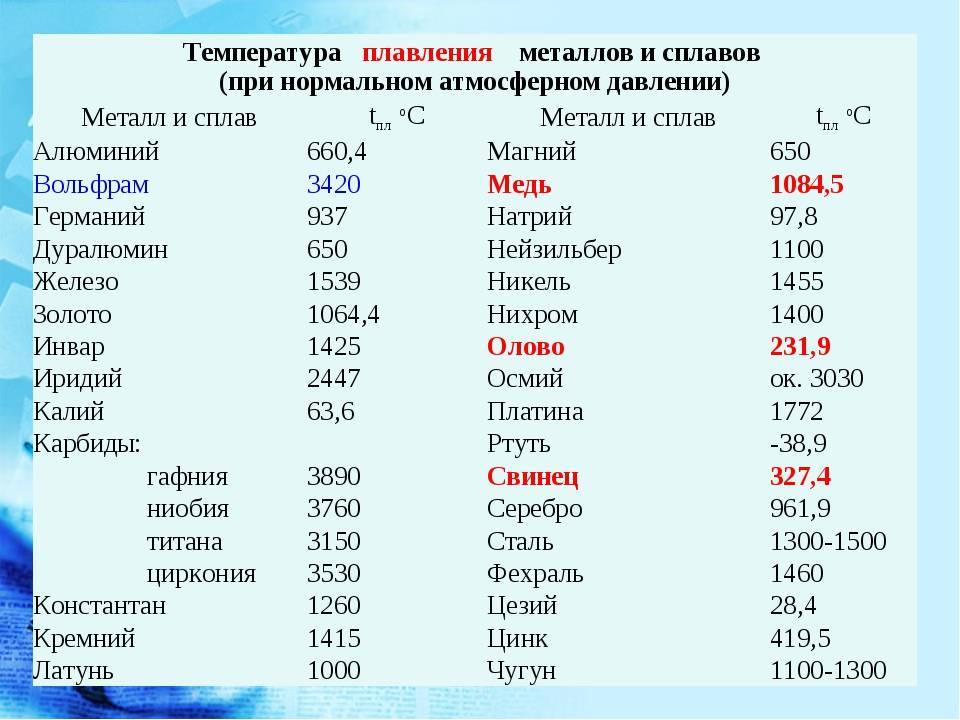
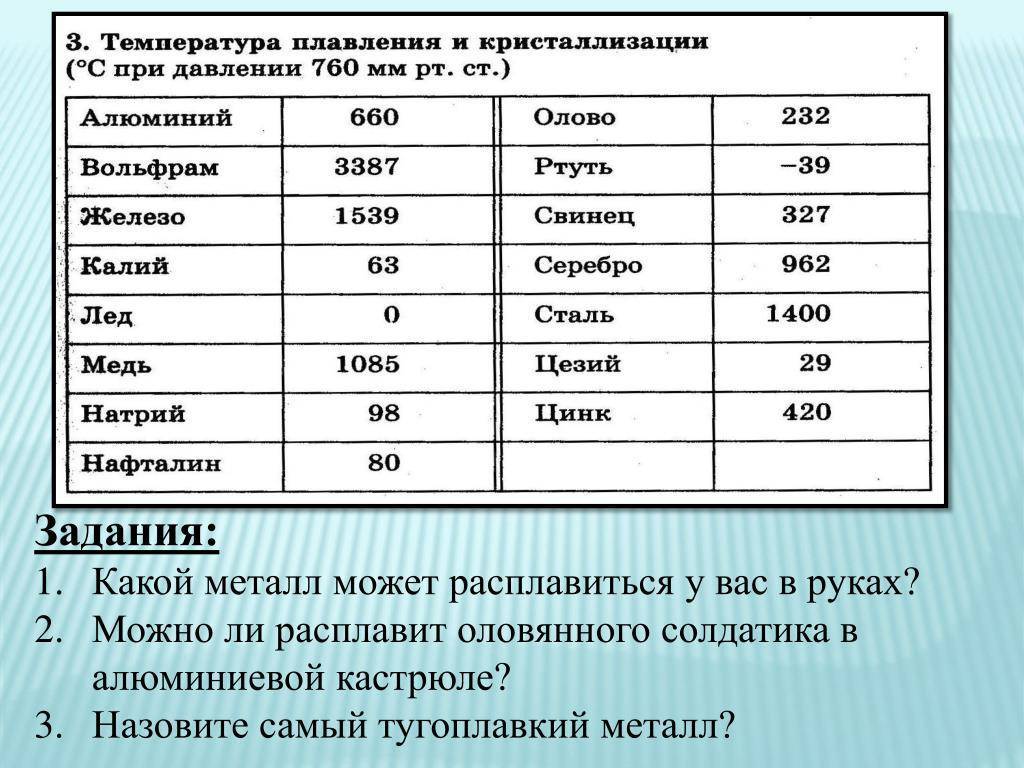
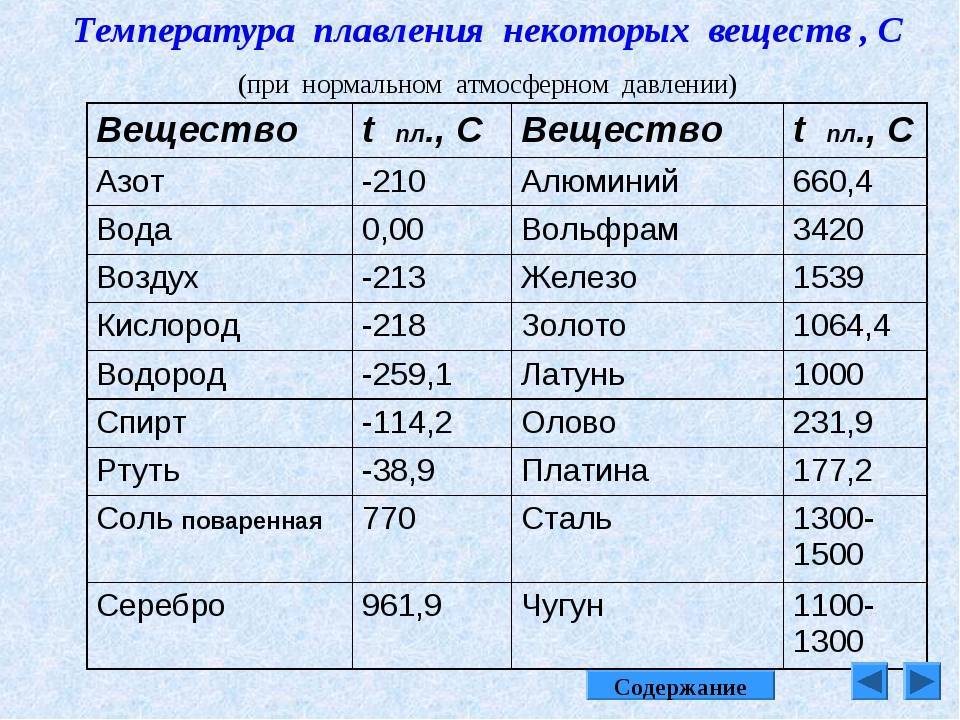
Методы избавления от оксида
Во время взаимодействия с воздухом между атомами металла и окружающей средой образуется ионная связь. Кислород отдает два электрона. На поверхности быстро возникает окислительный слой. Такая оксидная пленка способна предотвратить дальнейшее воздействие враждебной среды. Пленка, также становится барьером во время передачи электричества.
Оксидная пленка на продукте, изготовленном из свинца появляется через малый промежуток времени. Механическая очистка – довольно трудоемкое и бесполезное занятие. Сразу после успешного снятия слоя, образуя поле, и оголенные атомы вступают в связь с новыми атомами воздуха. Создать защиту для предмета можно при использовании масла подсолнуха. Также актуален вариант с графитовой смазкой и лаком.
Для домашнего обихода отлично подходит масло подсолнуха. Масло наливают в миску, после чего в жидкость помещают требуемое изделие из свинца. При правильной выдержки (около 5 минут), необходимо вытянуть изделие из масла и дать ему просохнуть на подготовленных салфетках.
В условиях производства для уменьшения распространения оксидных включений на поверхности деталей применяют графитовую смазку. Смазка не является редкой или дорогостоящей, однако в бытовых условиях она редко оказывается в наличии. Такое средство продается в автомагазинах и хозяйственных торговых точках. При должном отношении свинцовая поверхность будет длительное время демонстрировать блеск.

Графитовая смазка для свинца
Если оксидная пленка уже успешно покрыла поверхность, существуют способы ее удаления. Для этого, применяется концентрированный раствор кислоты. Для таких действий необходима специальная подготовка, включая наличие химического стеклянного инвентаря. Обычные столовые банки или миски не подойдут. Реактивные ингредиенты могут нанести вред человеку, оставить ожоги на теле.
Приветствуется использование защитных очков и маски.
Обрабатываемое изделие погружается в кислотный раствор. Необходимо подождать пока пленка оксида будет разрушена. После успешного подъема из раствора обрабатывается поверхность для защиты маслом или лаком.
Меры безопасности
При плавке свинца следует учитывать повышенную текучесть жидкого материала, который при попадании на кожу вызывает ожоги. Пролитый на одежду расплав пропитывает ткань, что усиливает термическое поражение. При попадании нагретого вещества на деревянные или пластиковые поверхности возможно возгорание, поэтому работы следует выполнять на расстоянии от предметов интерьера и с использованием защитной одежды и рукавиц, устойчивых к пропитке жидким свинцом.
Следует учитывать, что категорически запрещено охлаждать расплавленный металл водой. При попадании жидкости происходит интенсивный выброс мелких раскаленных частиц, вызывающих ожоги и приводящих к повреждению предметов интерьера в помещении или к пожару. При проведении работ необходимо защитить лицо маской и очками, а также использовать индивидуальный дыхательный прибор или респиратор.
Если плавка производится в замкнутом помещении (например дома или в гараже), то необходимо обеспечить принудительную вентиляцию. Вдыхание паров металла приводит к постепенному накапливанию свинца в костях. Предельно допустимая концентрация паров в атмосфере составляет 0,003 мг/м³, что лишний раз доказывает высокую токсичность металла и его соединений. Отдельно необходимо упомянуть сплавы с кадмием, пары которого вызывают раковые заболевания и поражают нервную и костную системы человека.
ПРИМЕНЕНИЕ

Висмутат свинца, сульфид свинца PbS, иодид свинца применяются в качестве катодного материала в литиевых аккумуляторных батареях. Хлорид свинца PbCl2 в качестве катодного материала в резервных источниках тока. Теллурид свинца PbTe широко применяется в качестве термоэлектрического материала (термо-э.д.с. 350 мкВ/К), самый широкоприменяемый материал в производстве термоэлектрогенераторов и термоэлектрических холодильников. Двуокись свинца PbO2 широко применяется не только в свинцовом аккумуляторе, но и также на её основе производятся многие резервные химические источники тока, например — свинцово-хлорный элемент, свинцово-плавиковый элемент и другие.
Свинцовые белила, основной карбонат Pb(OH)2•PbCO3, плотный белый порошок, — получается из свинца на воздухе под действием углекислого газа и уксусной кислоты. Использование свинцовых белил в качестве красящего пигмента теперь не так распространено, как ранее, из-за их разложения под действием сероводорода H2S. Свинцовые белила применяют также для производства шпатлёвки, в технологии цемента и свинцовокарбонатной бумаги.
Арсенат и арсенит свинца применяют в технологии инсектицидов для уничтожения насекомых — вредителей сельского хозяйства (непарного шелкопряда и хлопкового долгоносика).
Борат свинца Pb(BO2)2•H2O, нерастворимый белый порошок, используют для сушки картин и лаков, а вместе с другими металлами — в качестве покрытий стекла и фарфора.
Хлорид свинца PbCl2, белый кристаллический порошок, растворим в горячей воде, растворах других хлоридов и особенно хлорида аммония NH4Cl. Его применяют для приготовления мазей при обработке опухолей.
Хромат свинца PbCrO4 известен как хромовый жёлтый краситель, является важным пигментом для приготовления красок, для окраски фарфора и тканей. В промышленности хромат применяют в основном в производстве жёлтых пигментов.
Нитрат свинца Pb(NO3)2 — белое кристаллическое вещество, хорошо растворимое в воде. Это вяжущее ограниченного применения. В промышленности его используют в спичечном производстве, крашении и набивке текстиля, окраске рогов и гравировке.
Поскольку свинец хорошо поглощает γ-излучение, он используется для радиационной защиты в рентгеновских установках и в ядерных реакторах. Кроме того, свинец рассматривается в качестве теплоносителя в проектах перспективных ядерных реакторов на быстрых нейтронах.
Значительное применение находят сплавы свинца. Пьютер (сплав олова со свинцом), содержащий 85—90 % Sn и 15—10 % Pb, формуется, недорог и используется в производстве домашней утвари. Припой, содержащий 67 % Pb и 33 % Sn, применяют в электротехнике. Сплавы свинца с сурьмой используют в производстве пуль и типографского шрифта, а сплавы свинца, сурьмы и олова — для фигурного литья и подшипников. Сплавы свинца с сурьмой обычно применяют для оболочек кабелей и пластин электрических аккумуляторов. Было время, когда на оболочки кабелей шла значительная часть производимого в мире свинца, благодаря хорошим влагозащитным свойствам таких изделий. Однако впоследствии свинец в существенной мере вытеснили из этой области алюминий и полимеры. Так, в странах Запада использование свинца на оболочки кабелей упало с 342 тысяч тонн в 1976 году до 51 тысяч тонн в 2002 году. Соединения свинца используются в производстве красителей, красок, инсектицидов, стеклянных изделий и как добавки к бензину в виде тетраэтилсвинца (C2H5)4Pb (умеренно летучая жидкость, пары которой в малых концентрациях имеют сладковатый фруктовый запах, в больших — неприятный запах; Тпл = 130 °C, Ткип = +80 °С/13 мм рт. ст.; плотность 1,650 г/см³; nD2v = 1,5198; не растворяется в воде, смешивается с органическими растворителями; высокотоксичен, легко проникает через кожу; ПДК = 0,005 мг/м³; ЛД50 = 12,7 мг/кг (крысы, перорально)) для повышения октанового числа.
Используется для защиты пациентов от излучения рентгеновских аппаратов.
Свинец (англ. Lead) — Pb
| Молекулярный вес | 207.20 г/моль |
| Происхождение названия | от латинского plumbum |
| IMA статус | действителен, описан впервые до 1959 (до IMA) |
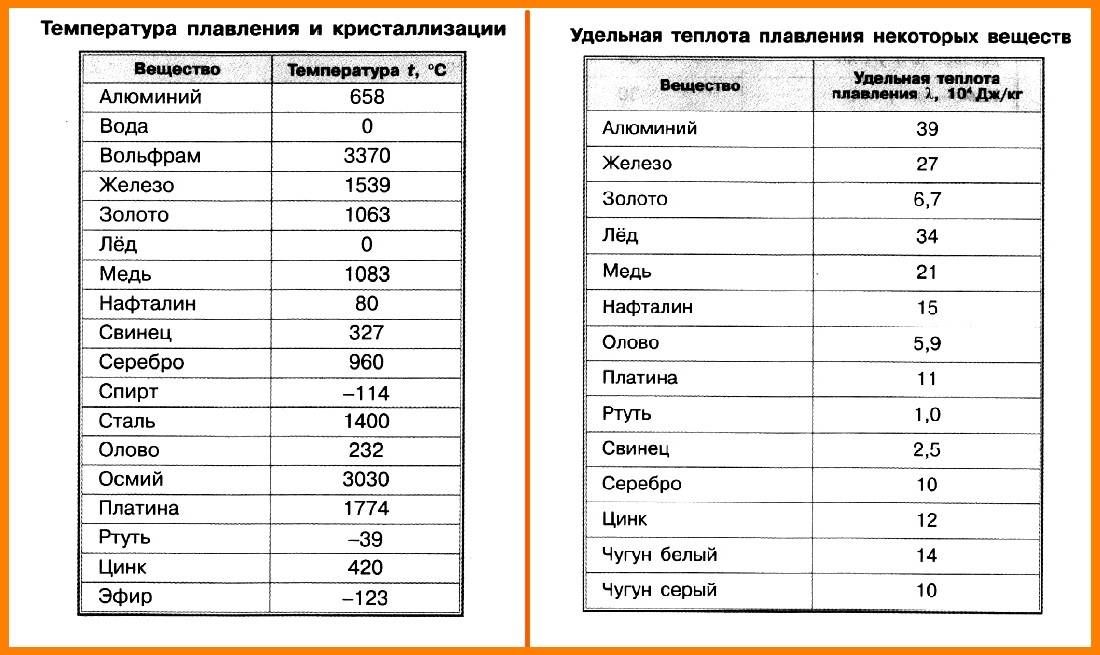
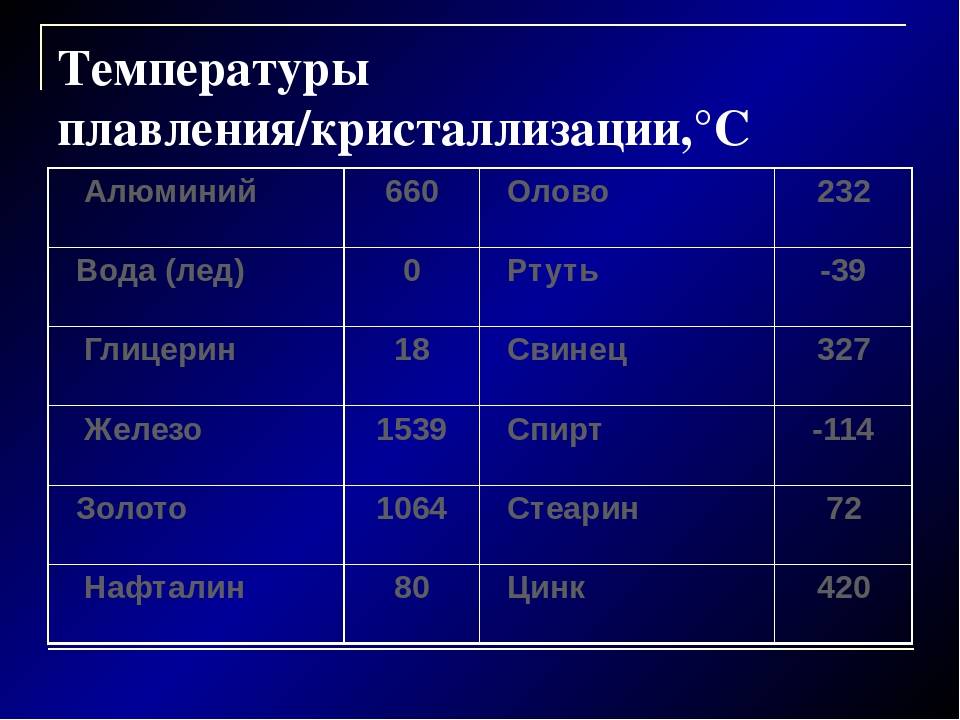
Свойства олова, его температура плавления
В природе редкий металл может быть в двух формах нахождения — в горных породах и минералах. Чаще всего элемент встречается в виде оловянного камня — окисного соединения. Раньше его выплавляли из руды, которую находили в верхних слоях земной коры. В настоящее время такие полезные ископаемые практически исчезли, поэтому процесс добычи олова стал намного сложней.
- До того момента, когда металл попадает в плавильное отделение, руда и россыпи, в составе которых есть олово проходят процесс обогащения. После этого концентрат направляют в обжиговые печи и только затем плавят.
- Редкий элемент имеет невысокую планку плавления, процесс плавления начинается при +231,9оС, при температуре +231,0оС металл остается твердым. Даже в охлажденном состоянии он легко гнется, а при нагревании становится податливым как пластилин. Процесс кипения олова начинается, когда температура во много раз превышает показатели плавления — 2630оС.
- Элемент бывает белого и серого цвета, более темный цвет он приобретает, когда переходит в порошкообразное состояние, в порошке плотность элемента значительно ниже, чем когда он находится в твердом состоянии.
В процессе плавки используются шлаки, флюсы, присадки для того, чтобы получить нужного сорта и качества металл. Низкая температура плавления сделала его стратегически важным металлом. Он легко может участвовать в образовании сплавов с другими материалами, благодаря низкой температуре плавления. В конечном итоге сплавы легко обрабатываются, затем они участвуют в соединении конструктивных узлов и деталей с хорошим герметичным швом.
Избавиться от оксида
Если оксидная пленка на поверхности теснее есть, ее дозволено снять концентрированной кислотой. Помните о том, что для химических экспериментов отменнее использовать посуду из химического стекла. Обыкновенная стеклянная банка может оказаться неудовлетворительно крепкой, а применять металлические либо пластиковые предметы и совсем неугодно
Не позабудьте также о мерах предосторожности – с резкими кислотами необходимо трудиться в перчатках. Желанна и защитная маска
Опустите предмет в кислоту, дождитесь, пока исчезнет оксидная пленка. Старательно слейте кислоту. Дайте изделию высохнуть, позже чего смажьте его маслом, графитовой смазкой либо покройте лаком. При работе со свинцом не забывайте, что данный материал токсичен.
Свинец знаменит с глубокой древности. Данный металл необходим во многих отраслях промышленности в силу своих физических и химических свойств. Для применения свинца нужно знать его температуру плавления, что дозволит производить из него надобные материалы и детали. Он легко поддается ковке, дюже грациозен, также такой металл отличает инертность к кислотам при типичной температуре.

ПРОИСХОЖДЕНИЕ

Образует вкрапленность в изверженных, главным образом кислых, горных породах, в м-ниях Fe и Мn ассоциирует с магнетитом и гаусманитом. Встречается в россыпях с самородными Au, Pt, Os, Ir.
В природных условиях часто образует крупные залежи свинцово-цинковых или полиметаллических руд стратиформного типа (Холоднинское, Забайкалье), а также скарнового (Дальнегорское (бывшее Тетюхинское), Приморье; Брокен-Хилл в Австралии) типа; галенит часто встречается и в месторождениях других металлов: колчеданно-полиметаллических (Южный и Средний Урал), медно-никелевых (Норильск), урановых (Казахстан), золоторудных и др. Сульфосоли обычно встречаются в низкотемпературных гидротермальных месторождениях с сурьмой, мышьяком, а также в золоторудных месторождениях (Дарасун, Забайкалье). Минералы свинца сульфидного типа имеют гидротермальный генезис, минералы окисного типа часты в корах выветривания (зонах окисления) свинцово-цинковых месторождений. В кларковых концентрациях свинец входит практически во все породы. Единственное место на земле, где в породах больше свинца по сравнению с ураном — Кохистанско-Ладакхская дуга на севере Пакистана.
Читать также: Сип 7 110 кв технические характеристики
Характеристика олова
 Плавится при 232 °C, кипит при 2600 °C, отлично сплавляется с разными металлами, благодаря высокой пластичности хорошо поддается ковке. Паяльное олово используется в качестве припоя, так как оно хорошо смачивает металлы. Промышленное получение олова значительно сложнее чем свинца, поэтому оно гораздо дороже.
Плавится при 232 °C, кипит при 2600 °C, отлично сплавляется с разными металлами, благодаря высокой пластичности хорошо поддается ковке. Паяльное олово используется в качестве припоя, так как оно хорошо смачивает металлы. Промышленное получение олова значительно сложнее чем свинца, поэтому оно гораздо дороже.
В отличие от свинца олово выглядит гораздо привлекательнее. Этот серебристо-белый металл безопасен для здоровья человека. Оловом часто покрывают поверхности металлических изделий в местах, где они контактируют с пищей: посуду, консервную жесть, пищевую фольгу и другие. Однако оловянная пыль и пары при вдыхании могут вызвать опасное влияние на человеческий организм. Кроме производства тары для продуктов питания, олово широко используется в разных припоях и других сплавах, например, в антифрикционных и подшипниковых. Этот материал значительно легче свинца, его плотность 7,3 г/куб.см.
https://youtube.com/watch?v=I33GCWrUJFE
Олово полиморфно, то есть оно может существовать в различных модификациях в зависимости от температуры. При температуре ниже 13 °C белое олово (β-модификация) переходит в серое олово (α-модификацию). В результате этого фазового перехода блестящие оловянные изделия рассыпаются в порошок серого цвета. Причем при контакте с порошком белое олово как бы заражается от него и превращается в серое. Такое явление получило название «оловянная чума».
По некоторым данным, именно оно стало главной причиной гибели экспедиции Роберта Скотта на Южный полюс. Керосин, хранившийся на промежуточных складах, вытек из канистр, пропаянных по швам оловом, которое рассыпалось в порошок на морозах Антарктики. Таким образом, члены экспедиции остались почти без топлива.
ЗАПАСЫ И ДОБЫЧА

Для получения свинца в основном используют руды, содержащие галенит. Сначала методом флотации получают концентрат, содержащий 40—70 процентов свинца. Затем возможно несколько способов переработки концентрата в веркблей (черновой свинец): прежде широко распространённый метод шахтной восстановительной плавки, разработанные в СССР метод кислородно-взвешенной циклонной электротермической плавки свинцово-цинковых продуктов (КИВЦЭТ-ЦС), метод плавки Ванюкова (плавка в жидкой ванне). Для плавки в шахтной (ватержакетной) печи предварительно производят агломерационный обжиг концентрата, а затем его загружают в шахтную печь, где происходит восстановление свинца из оксида.
Веркблей, содержащий более 90 процентов свинца, подвергается дальнейшему очищению. Сначала для удаления меди применяют зейгерование и последующую обработку серой. Затем щелочным рафинированием удаляют мышьяк и сурьму. Далее выделяют серебро и золото с помощью цинковой пены и отгоняют цинк. Обработкой кальцием и магнием удаляют висмут. В результате содержание примесей падает до менее чем 0,2 %[
Подготовка к плавлению свинца
Для начала нужно найти ёмкость. Будет отлично, если ручка сосуда будет сделана из какого-нибудь жароустойчивого материала. Для этой цели можно воспользоваться старым кофейником или чайником.
Материал можно плавить и в устаревшей посуде, сделанной из чугуна, пользуясь глубокой и длинной ложкой для заливки.
Если поблизости нет подходящей ёмкости, то можно применить и обыкновенную консервную «жестянку». Однако, здесь следует пользоваться пассатижами, которые будут использоваться для снятия раскалённой посуды с пламени и заливки материала в форму.
Не забывайте, что во время работы нужно быть предельно осторожным. Чтобы упростить процедуру, на одной стороне банки можно сделать небольшой желобок. В таком случае раскалённый металл будет выливаться тоненькой струйкой чётко в необходимое место.
Очищенный от примесей материал можно помельчить, чтобы он расплавился как можно скорее. Ёмкость нужно надёжным образом поставить над горелкой и как следует прогреть. Это нужно сделать для того чтобы избавить поверхность от лишних примесей и влаги.
Процедура плавки
Не нужно пытаться расплавить сразу весь подготовленный свинец, ведь взаимодействовать с раскалённой поверхностью ёмкости будет лишь самый нижний слой.
Сначала расплавьте два-три куска, чтобы сформировалась лужица, после чего постепенно накидывайте новый материал. Так у вас появится возможность сделать рабочую площадь более объёмной.
После плавления с поверхности металла нужно убрать слой мусора, примесей и шлака. Заливка должна осуществляться в нагретую форму. А также свинец характеризуется оперативным застыванием. Материал быстро утрачивает текучесть, становится более густым, в связи с чем не может полностью наполнить собой форму.
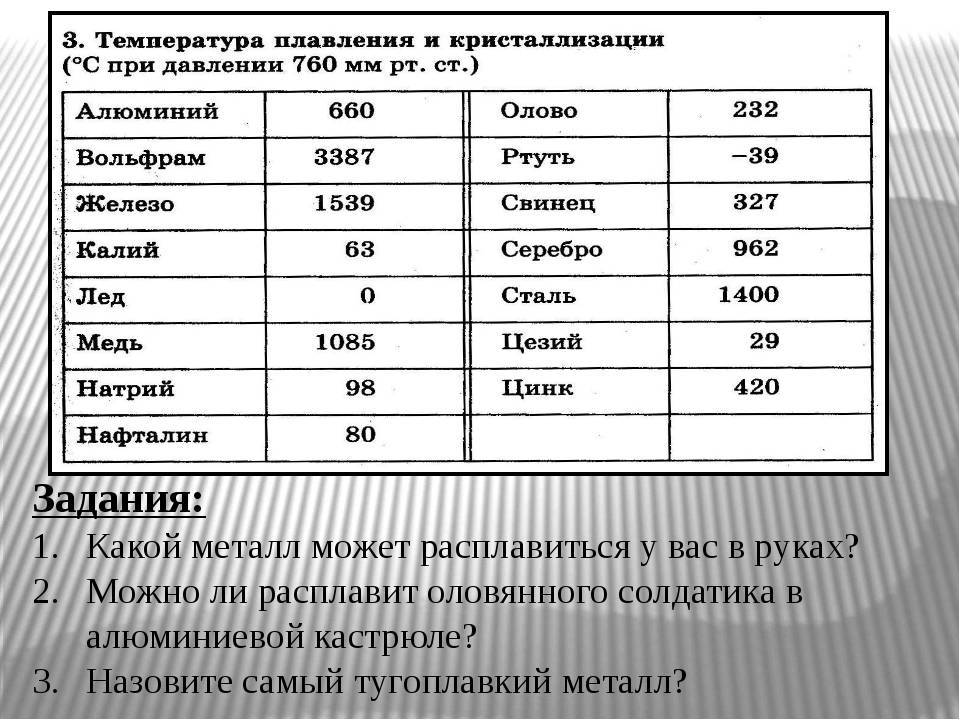
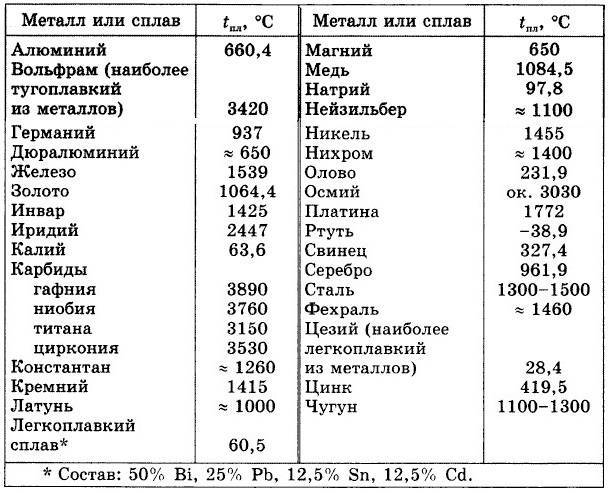
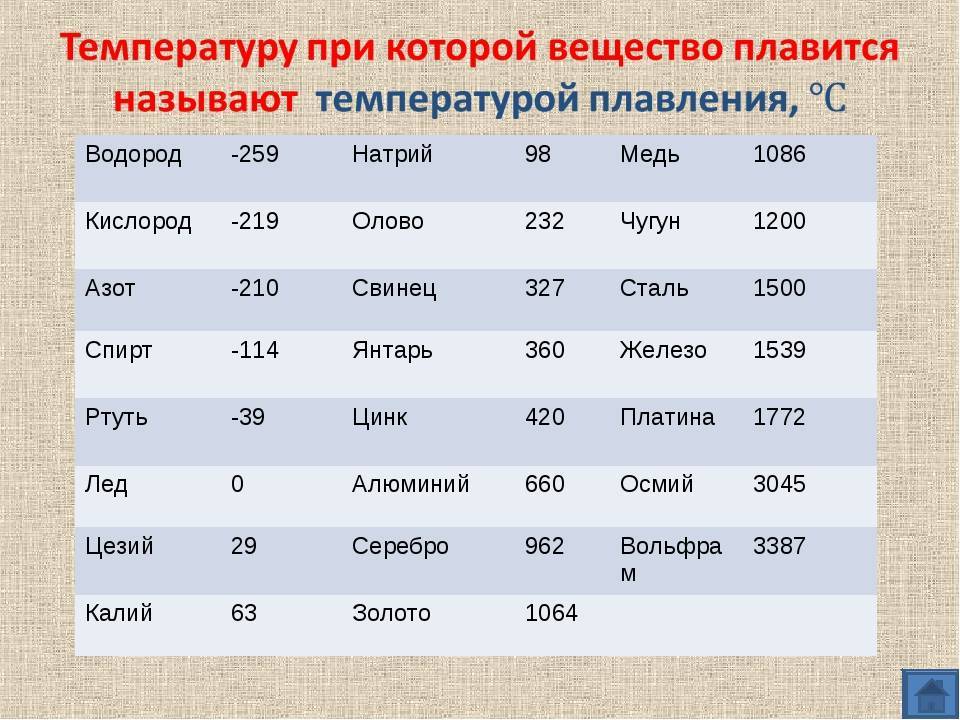
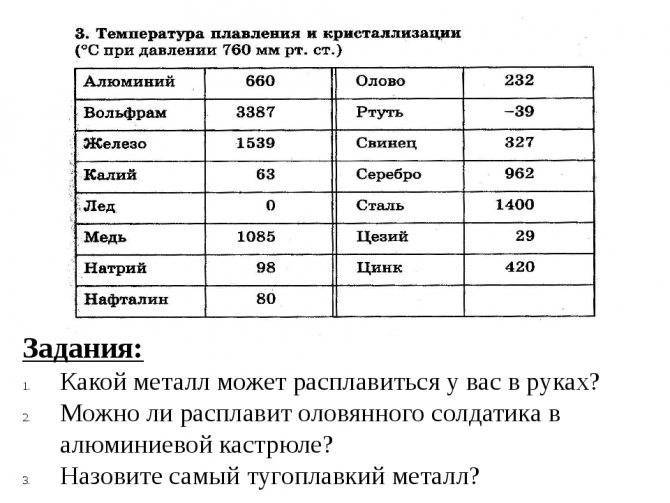
У какого металла самая высокая температура плавления

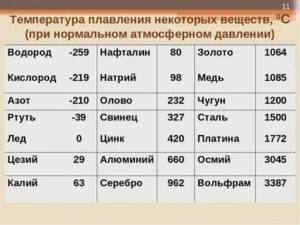
Вольфрам – самый тугоплавкий металл, 3422 °C (6170 °F).
Твердый, тугоплавкий, достаточно тяжелый материал светло-серого цвета, который имеет металлический блеск. Механической обработке поддается с трудом. При комнатной температуре достаточно хрупок и ломается. Ломкость металла связана с загрязнением примесями углерода и кислорода.
Вольфрам можно получить из руды, благодаря сложным химическим переработкам, в качестве порошка. Используя прессование и спекание, из него создают детали обычной формы и бруски.
Вольфрам — крайне стойкий элемент к любым температурным воздействиям. По этой причине размягчить вольфрам не могли более сотни лет. Не существовало такой печи, которая смогла бы нагреться до нескольких тысяч градусов по Цельсию. Ученым удалось доказать, что это самый тугоплавкий металл. Хотя бытует мнение, что сиборгий, по некоторым теоретическим данным, имеет большую тугоплавкость, но это лишь предположение, поскольку он является радиоактивным элементом и у него небольшой срок существования.
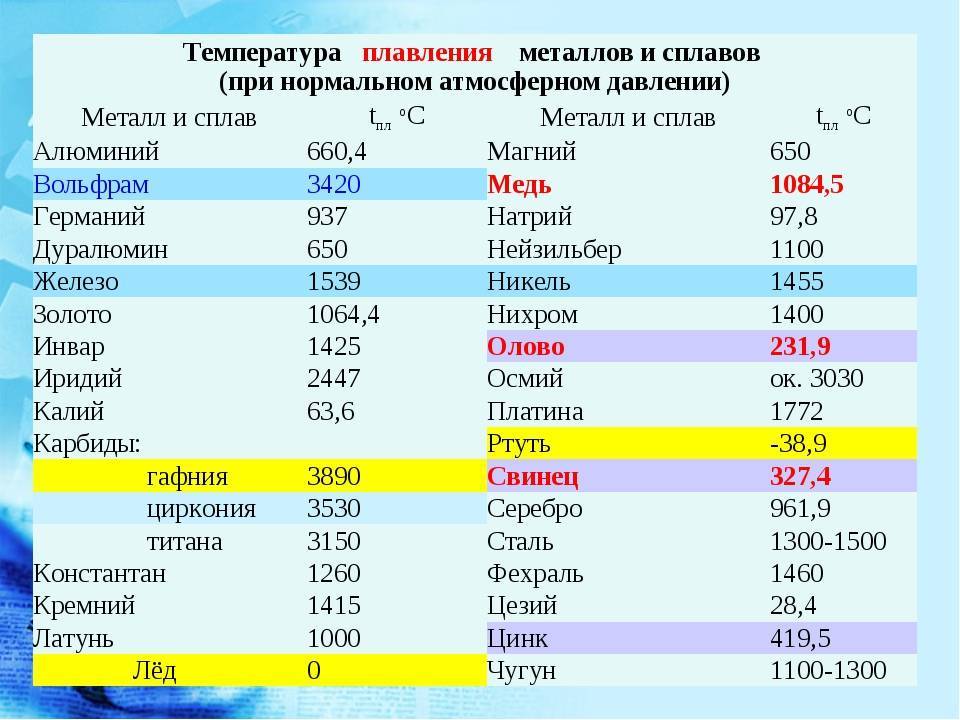
Свойства свинца (таблица): температура, плотность, давление и пр.:
| 100 | Общие сведения | |
| 101 | Название | Свинец |
| 102 | Прежнее название | |
| 103 | Латинское название | Plumbum |
| 104 | Английское название | Lead |
| 105 | Символ | Pb |
| 106 | Атомный номер (номер в таблице) | 82 |
| 107 | Тип | Металл |
| 108 | Группа | Амфотерный, тяжёлый, цветной металл |
| 109 | Открыт | Известен с глубокой древности. |
| 110 | Год открытия | 7000 до н. э. |
| 111 | Внешний вид и пр. | Ковкий, сравнительно легкоплавкий, тяжёлый металл серебристо-белого цвета с синеватым отливом |
| 112 | Происхождение | Природный материал |
| 113 | Модификации | |
| 114 | Аллотропные модификации | |
| 115 | Температура и иные условия перехода аллотропных модификаций друг в друга | |
| 116 | Конденсат Бозе-Эйнштейна | |
| 117 | Двумерные материалы | |
| 118 | Содержание в атмосфере и воздухе (по массе) | 0 % |
| 119 | Содержание в земной коре (по массе) | 0,00099 % |
| 120 | Содержание в морях и океанах (по массе) | 3,0·10-9 % |
| 121 | Содержание во Вселенной и космосе (по массе) | 1,0·10-6 % |
| 122 | Содержание в Солнце (по массе) | 1,0·10-6 % |
| 123 | Содержание в метеоритах (по массе) | 0,00014 % |
| 124 | Содержание в организме человека (по массе) | 0,00017 % |
| 200 | Свойства атома | |
| 201 | Атомная масса (молярная масса) | 207,2(1) а. е. м. (г/моль) |
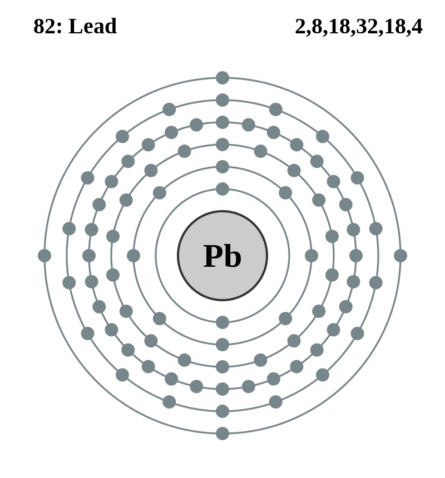
| 202 | Электронная конфигурация | 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 4f14 5s2 5p6 5d10 6s2 6p2 |
| 203 | Электронная оболочка | K2 L8 M18 N32 O18 P4 Q0 R0
|
| 204 | Радиус атома (вычисленный) | 154 пм |
| 205 | Эмпирический радиус атома* | 180 пм |
| 206 | Ковалентный радиус* | 146 пм |
| 207 | Радиус иона (кристаллический) | Pb2+ 112 (4) пм, 133 (6) пм, 143 (8) пм, 163 (12) пм, Pb4+ 79 (4) пм, 91,5 (6) пм, 108 (8) пм (в скобках указано координационное число – характеристика, которая определяет число ближайших частиц (ионов или атомов) в молекуле или кристалле) |
| 208 | Радиус Ван-дер-Ваальса | 202 пм |
| 209 | Электроны, Протоны, Нейтроны | 82 электрона, 82 протона, 125 нейтронов |
| 210 | Семейство (блок) | элемент p-семейства |
| 211 | Период в периодической таблице | 6 |
| 212 | Группа в периодической таблице | 14-ая группа (по старой классификации – главная подгруппа 4-ой группы) |
| 213 | Эмиссионный спектр излучения | |
| 300 | Химические свойства | |
| 301 | Степени окисления | -4, -2, -1, 0, +1, +2, +3, +4 |
| 302 | Валентность | II, IV |
| 303 | Электроотрицательность | 2,33 (шкала Полинга) |
| 304 | Энергия ионизации (первый электрон) | 715,6 кДж/моль (7,4166799(6) эВ) |
| 305 | Электродный потенциал | Pb2+ + 2e– → Pb, Eo = -0,126 В, Pb4+ + 4e– → Pb, Eo = +0,77 В, Pb4+ + 2e– → Pb2+, Eo = +1,694 В |
| 306 | Энергия сродства атома к электрону | 35,1 кДж/моль |
| 400 | Физические свойства | |
| 401 | Плотность* | 11,34 г/см3 (при 20 °C и иных стандартных условиях, состояние вещества – твердое тело), 10,66 г/см3 (при температуре плавления 327,46 °C и иных стандартных условиях, состояние вещества – жидкость) |
| 402 | Температура плавления* | 327,46 °C (600,61 K, 621,43 °F) |
| 403 | Температура кипения* | 1749 °C (2022 K, 3180 °F) |
| 404 | Температура сублимации | |
| 405 | Температура разложения | |
| 406 | Температура самовоспламенения смеси газа с воздухом | |
| 407 | Удельная теплота плавления (энтальпия плавления ΔHпл) | 4,77 кДж/моль |
| 408 | Удельная теплота испарения (энтальпия кипения ΔHкип)* | 179,5 кДж/моль |
| 409 | Удельная теплоемкость при постоянном давлении | |
| 410 | Молярная теплоёмкость | 26,65 Дж/(K·моль) |
| 411 | Молярный объём | 18,3 см³/моль |
| 412 | Теплопроводность | 35,3 Вт/(м·К) (при стандартных условиях), 35,3 Вт/(м·К) (при 300 K) |
| 500 | Кристаллическая решётка | |
| 511 | Кристаллическая решётка #1 | |
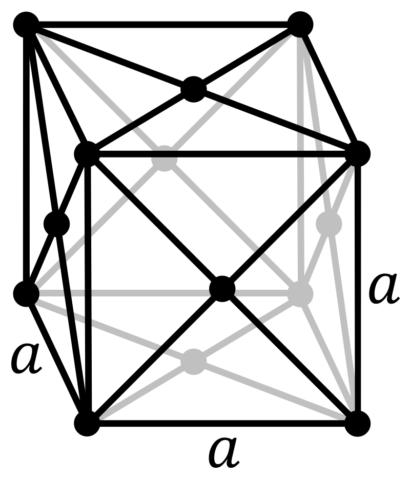
| 512 | Структура решётки | Кубическая гранецентрированная
|
| 513 | Параметры решётки | 4,950 Å |
| 514 | Отношение c/a | |
| 515 | Температура Дебая | 88 K |
| 516 | Название пространственной группы симметрии | Fm_ 3m |
| 517 | Номер пространственной группы симметрии | 225 |
| 900 | Дополнительные сведения | |
| 901 | Номер CAS | 7439-92-1 |
Примечание:
205* Эмпирический радиус атома свинца согласно и составляет 175 пм.
206* Ковалентный радиус свинца согласно и составляет 146±5 пм и 147 пм соответственно.
401* Плотность свинца согласно и составляет 11,3415 г/см3 (при 0 °C и иных стандартных условиях, состояние вещества – твердое тело) и 11,336 г/см3 (при 20 °C и иных стандартных условиях, состояние вещества – твердое тело) соответственно, а также 10,686 г/см3 (при 327,4 °C и иных стандартных условиях, состояние вещества – жидкость).
402* Температура плавления свинца согласно составляет 327,4 °C (600,55 K, 621,32 °F).
403* Температура кипения свинца согласно составляет 1745 °C (2018,15 К, 3173 °F).
408* Удельная теплота испарения (энтальпия кипения ΔHкип) свинца согласно и составляет 177,8 кДж/моль и 177,7 кДж/моль соответственно.
Химические свойства
| Этот раздел не завершён. Вы поможете проекту, исправив и дополнив его. |
Электронная формула: 5s25p65d106s26p2, энергия ионизации (Pb → Pb+ + e−) равна 7,42 эВ. На внешней электронной оболочке находятся 4 неспаренных электрона (2 на p- и 2 на d-подуровнях), поэтому основные степени окисления атома свинца — +2 и +4.
Соли двухвалентного свинца реагируют со щелочами, образуя почти нерастворимый гидроксид свинца:
P b 2 + + 2 O H − = P b ( O H ) 2 {\displaystyle \mathrm {Pb^{2+}} +\mathrm {2OH^{-}} =\mathrm {Pb(OH)_{2}} }
При избытке щёлочи гидроксид растворяется:
P b ( O H ) 2 + 2 O H − = 2 − {\displaystyle \mathrm {Pb(OH)_{2}+2OH^{-}=^{2-}} }
Реагирует со щелочами и кислотами:
Реакция диспропорционирования между PbO2 и Pb лежит в основе работы свинцовых аккумуляторов.
Приготовление расплава и температура плавления свинца
Температура плавления свинца позволяет использовать металл в технических целях для изготовления деталей, образования сплавов
Переплавку материала можно проводить в кустарных условиях, соблюдая при этом меры предосторожности
Приготовление расплава
Плавление материала предусматривает процесс перехода из твердого состояния в жидкость под влиянием температурного градиента. Этот показатель имеет зависимость от характеристик компонентов, формирующих сплав.
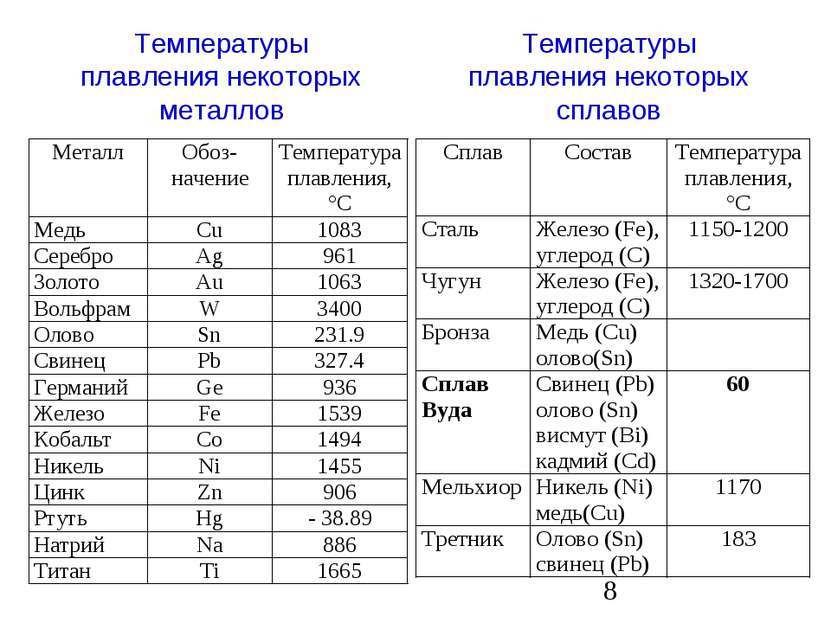
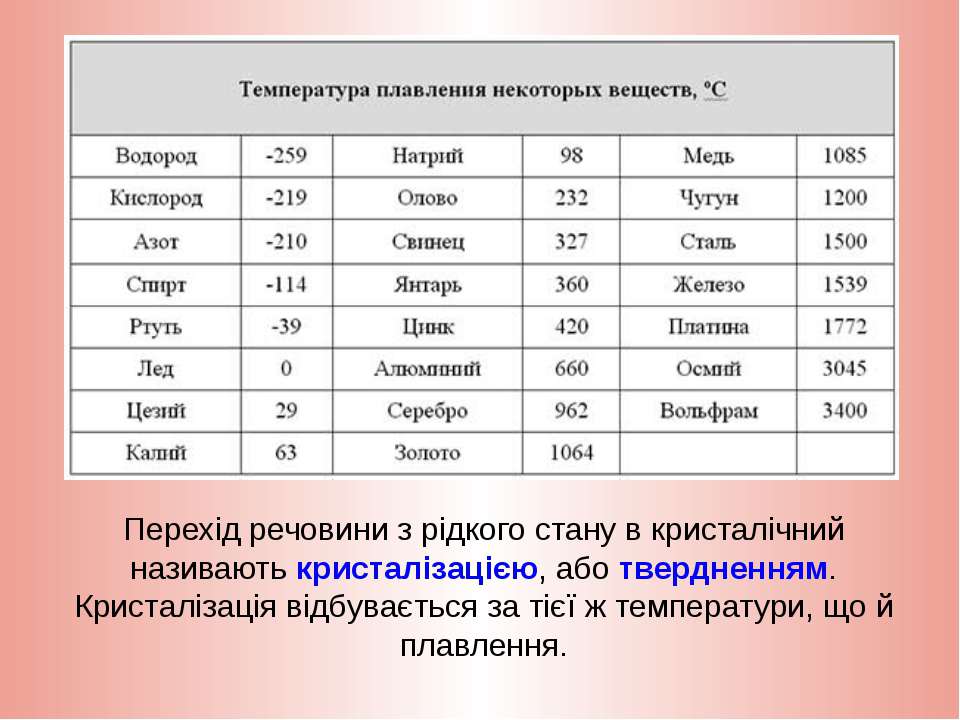
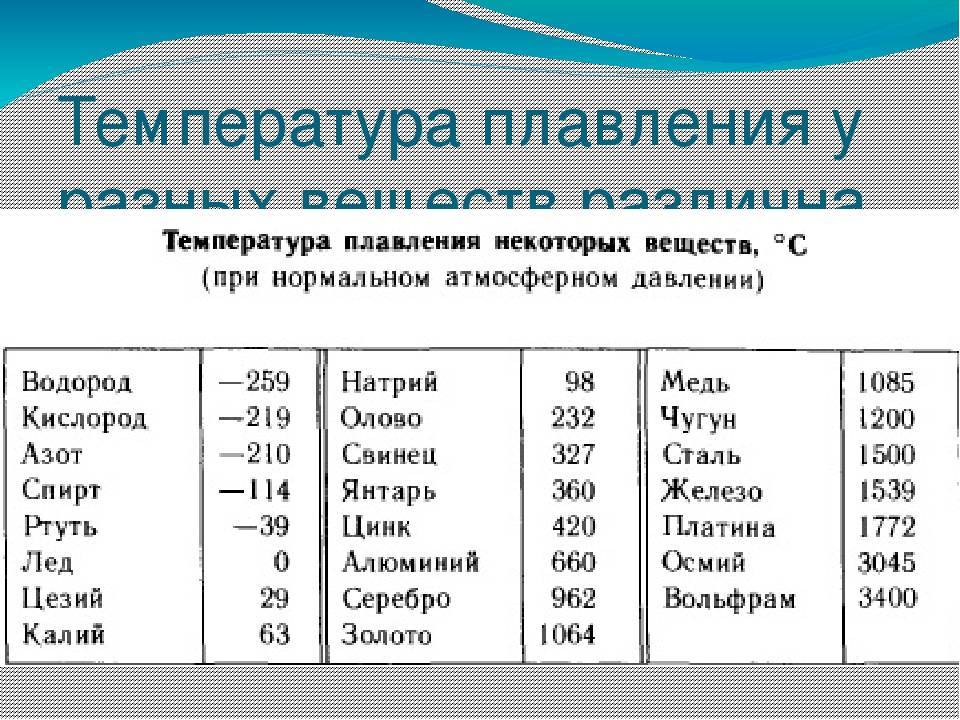
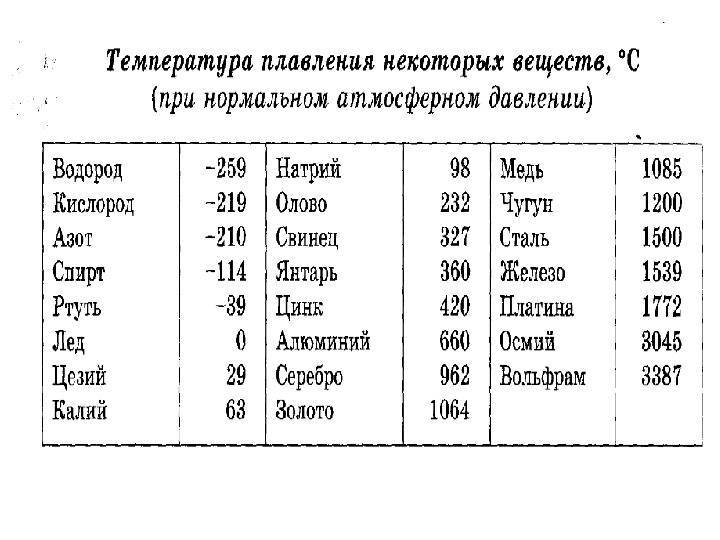
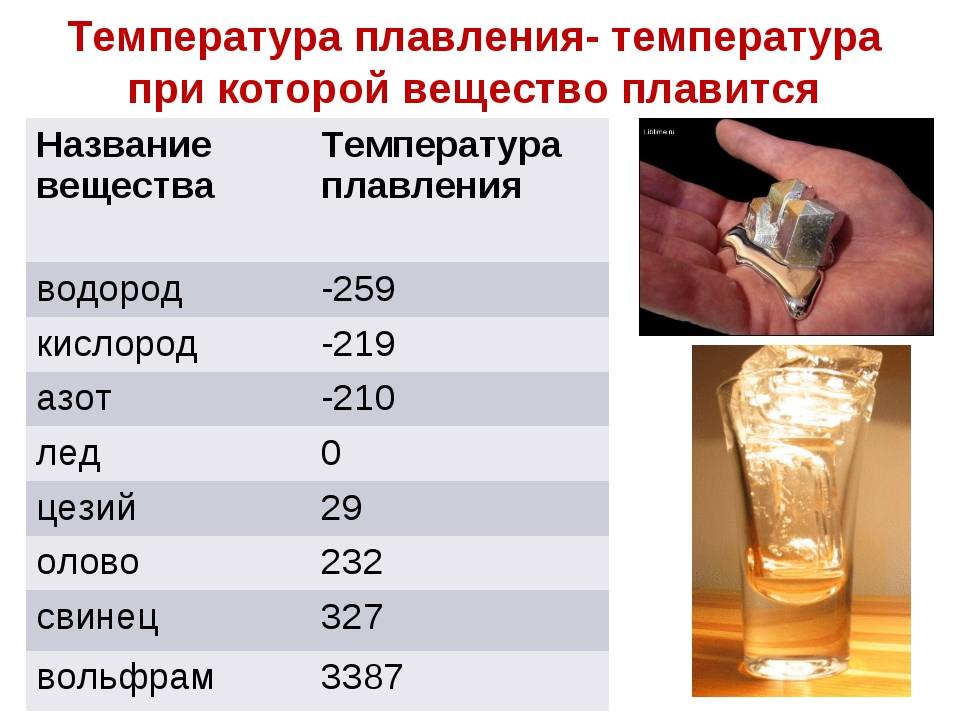
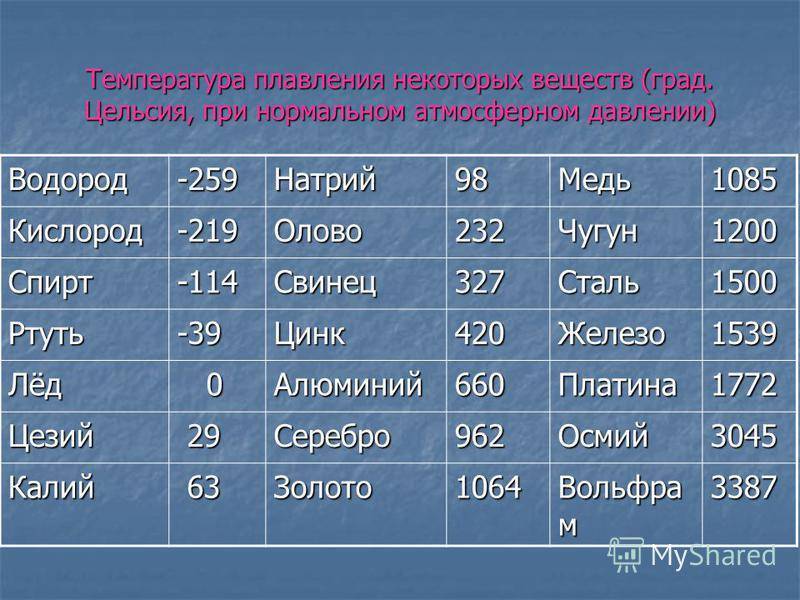
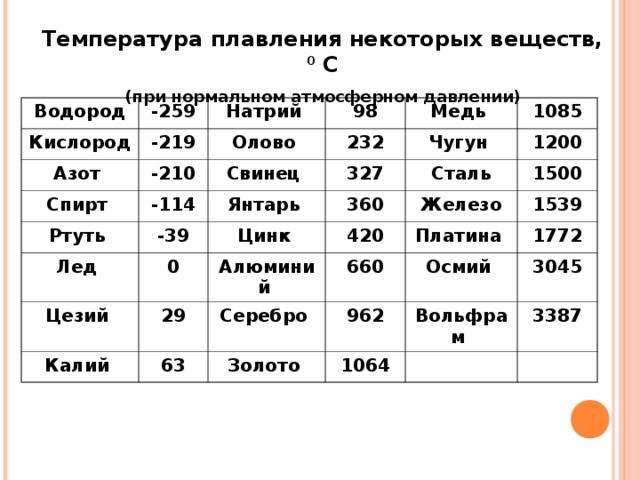
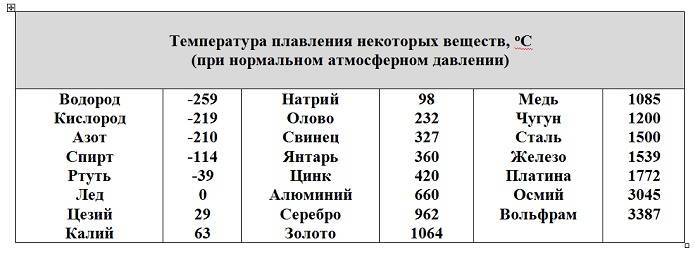
К примеру, температура плавления свинца составляет 327 °C, а олова – 232 °C. Для припоя, состоящего из этих материалов, температура перехода в жидкость составляет 183 °C.
Плавка материалов происходит при нагревании. Показатель перехода в жидкое состояние называется температурой плавления.
Плотность свинца составляет 11,3 г/см³.Удельная теплота плавления свинца составляет 25 кДж/кг. Материал отличается большой вязкостью, его трудно разломать на части. В то же время он очень мягкий, на нем остается вмятина от нажатия ногтем.
Металл легко разрезается ножом.
Температура плавления -температура, при которой металл переходит в жидкое состояние.
Температура плавления свинца позволяет разогревать его в ковше на простом очаге с последующим отливом в формы.
Удельная теплоемкость свинца при комнатной температуре равна 127,5 Дж/кг, а при нагревании металла до кипения показатель увеличивается.
Переплавка в кустарных условиях
- Свинец, температура плавления которого низкая, позволяет его использование для литья разнообразных поделок, грузил для рыбалки в домашних условиях. Формировать расплав несложно, но при этом необходимо соблюдать элементарную безопасность и внимательность.
- Плавку металла следует проводить в хорошо проветриваемом помещении. Источником тепла можно выбрать ручную горелку, а в качестве сосуда использовать емкость из более прочного и устойчивого к нагреванию металла.
- Поместив материал в емкость для нагревания, включить источник тепла на максимальную мощность и направить температурный поток ближе к расплавляемому материалу. Для перевода в жидкость значительного количества сырья потребуется некоторое время.
- После выключения горелки расплавленный материал можно заливать в подготовленную форму для литья. Надев специальные рукавицы, аккуратно взять емкость с жидкостью, слегка вращая для предотвращения образования пузырей.
- Заливать металл в форму нужно на расстоянии, чтобы не обжечь открытые части тела горячими испарениями свинца. После заливки форму оставить остывать до безопасной температуры.
- Пролитый расплав можно легко механически удалить с поверхности с помощью отвертки или долота и использовать его при следующей плавке.
- Материал хорошо смешивается с другими металлами, что влияет на состав и качество отливки. При работе необходимо использовать спецодежду и плотные рукавицы для защиты кожи рук от попадания металлической пыли.
- Перед заливкой нужно удостовериться, что форма абсолютно сухая. При наличии влаги может произойти мгновенное ее испарение, что повлечет за собой попадание расплава на тело.
Применение металла
Свинец известен человечеству несколько тысячелетий. Еще в Древнем Риме его использовали для изготовления труб для транспортировки воды.
В природе существует примерно 180 минералов, включающих в состав химический элемент №82. Месторождения свинца часто сочетаются с рудами меди, висмута, цинка, серебра.
На сегодня применение металла в промышленном производстве позволяет изготавливать:
пластины для аккумуляторов;
оболочки силовых кабелей;
типографские шрифты;
сплавы и припои;
сплавы для изготовления подшипников;
красители;
пули и дроби для охоты.
А также он используется как средство защиты от радиоактивного излучения.
Свинец широко используется в жизнедеятельности человека.
До недавнего времени металл применяли с целью увеличения октанового числа топлива и обнаружения H2S, но постепенно от данного метода начали отказываться.
Свинец является токсичным химическим элементом. Отравление металлом и его соединениями возможно при разработке рудных месторождений, выплавке и использовании в производстве.
Бытовые отравления происходят по причине длительного хранения продуктов в упаковках или посуде, покрытой глазурью, содержащей свинец.